写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:。
未发生化学键破坏的是;仅发生离子键破坏的是;仅发生共价键破坏的是;既发生离子键又发生共价键破坏的是;
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.037 | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘(2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O),生成的碘可用淀粉溶液检验,根据出现蓝色所需的 时间来衡量该反应的速率。
实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
① | 5 | 5 | V1 | 0 | |
② | 5 | 5 | 40 | 25 | |
③ | 5 | V2 | 35 | 25 |
则V1=mL,V2=mL.
实验步骤:
ⅰ.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4 , 充分振荡;
ⅲ.向乙中滴加试剂X。
①写出KI和FeCl3反应的离子方程式:。
②步骤ⅲ中,试剂X是。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度,该实验现象是:
ⅱ中。
ⅲ中 。

①该反应是(填“吸热”或“放热”)反应,其原因是反应物化学键断裂吸收的总能量(填“大于”或“小于”)生成物化学键形成放出的总能量。
②关于N2和H2在催化剂表面合成氨气的过程,下列说法正确的是(填序号)。
A.图甲中曲线a表示有催化剂时的能量变化情况
B.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C.在图乙②过程中,N2、H2断键形成氮原子和氢原子
D.使用催化剂可以使生成的氨气的量增多
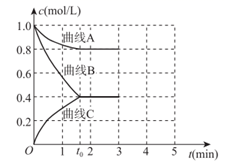
①表示c(N2)变化的曲线是(填“A”“B”或“C”)。
②0~t0时用H2表示的化学反应速率:v(H2)=mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是(填序号,可多选)。
a.容器中的压强不随时间变化
b.2c(H2)=3c(NH3)
c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键

写出咖啡酸中两种含氧官能团的名称:、。

苯乙烯与Br2/CCl4反应生成B的实验现象为,1mol苯乙烯最多能和mol的Br2/CCl4的溶液反应。
A.同分异构体 B.同系物 C.同素异形体 D.都不是