
浸出后溶液循环浸取并析出PbCl2的实验结果如下表所示。
| 参数 | 循环次数 | |||
| 0 | 1 | 2 | 3 | |
| 结晶产品中PbCl2纯度/% | 99.9 | 99.3 | 98.7 | 94.3 |
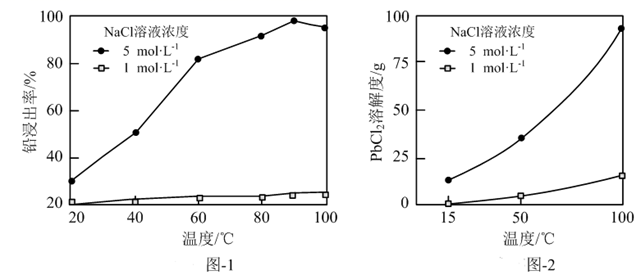
①为提高原料NaCl溶液利用率,请补充完整利用酸浸渣制备化学纯(纯度≥98.5 %)PbCl2晶体的实验方案:取一定质量的酸浸渣,,将所得晶体洗涤、干燥。(可选用的试剂:5 mol·L-1NaCl溶液,1 mol·L-1NaCl溶液,NaCl固体)
②循环一定次数后的溶液中加入适量CaCl2溶液,过滤并加水稀释至其中NaCl浓度为1 mol·L-1的目的是。