步骤1:将电石渣与水混合,形成浆料。
步骤2:控制电石渣过量,75℃时向浆料中通入Cl2 , 该过程会生成Ca(ClO)2 , Ca(ClO)2会进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2分解为CaCl2和O2 , 过滤。
步骤3:向滤液中加入稍过量KCl固体,蒸发浓缩、冷却至25℃结晶,得KClO3。
下列说法正确的是( )
| 实验 | 实验操作和现象 |
| 1 | 测得0.1mol·L−1Na2C2O4溶液的pH≈8.4 |
| 2 | 向0.2mol·L−1Na2C2O4溶液中加入等体积0.2mol·L−1盐酸,测得混合后溶液的pH≈5.5 |
| 3 | 向0.1mol·L−1Na2C2O4溶液中滴加几滴酸性KMnO4溶液,振荡,溶液仍为无色 |
| 4 | 向0.1mol·L−1Na2C2O4溶液中加入等体积0.1mol·L−1CaCl2溶液,产生白色沉淀 |
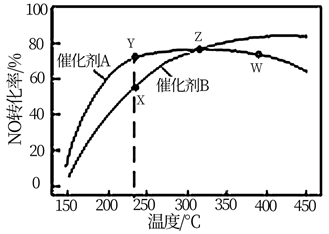
下列有关说法错误的是( )
①若沉钛后c(TiO2+)<1×10−5 mol·L−1 , 则需要调节溶液的pH略大于。
②TiO2+水解生成TiO(OH)2的离子方程式为。
③加入铁粉的作用是。

①TiO2的一种晶胞结构如图-1所示,每个O周围距离最近的Ti数目是。
②纳米TiO2在室温下可有效催化降解空气中的甲醛。H2O和甲醛都可在催化剂表面吸附,光照时,吸附的H2O与O2产生HO,从而降解甲醛。空气的湿度与甲醛降解率的关系如图-2所示,甲醛降解率随空气湿度变化的原因为。

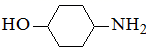 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。 ①分子中有一个含氮五元环;
②核磁共振氢谱显示分子中有5种不同化学环境的氢原子;
③红外光谱显示分子中无甲基。
 ,
,  易被氧化(R为H或烃基)。
易被氧化(R为H或烃基)。 设计以  和
和 ![]() 为原料制备
为原料制备  的合成路线 (无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线 (无机试剂和有机溶剂任用,合成路线示例见本题题干)。

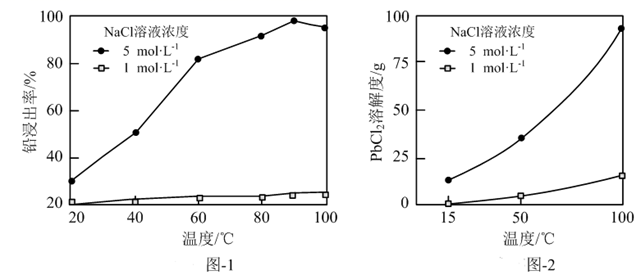
浸出后溶液循环浸取并析出PbCl2的实验结果如下表所示。
| 参数 | 循环次数 | |||
| 0 | 1 | 2 | 3 | |
| 结晶产品中PbCl2纯度/% | 99.9 | 99.3 | 98.7 | 94.3 |
①为提高原料NaCl溶液利用率,请补充完整利用酸浸渣制备化学纯(纯度≥98.5 %)PbCl2晶体的实验方案:取一定质量的酸浸渣,,将所得晶体洗涤、干燥。(可选用的试剂:5 mol·L-1NaCl溶液,1 mol·L-1NaCl溶液,NaCl固体)
②循环一定次数后的溶液中加入适量CaCl2溶液,过滤并加水稀释至其中NaCl浓度为1 mol·L-1的目的是。
①酸性条件下,该催化过程中产生HO的反应的离子方程式为。
②在不同初始pH条件下,研究苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是。
