⒈煅烧:煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为.
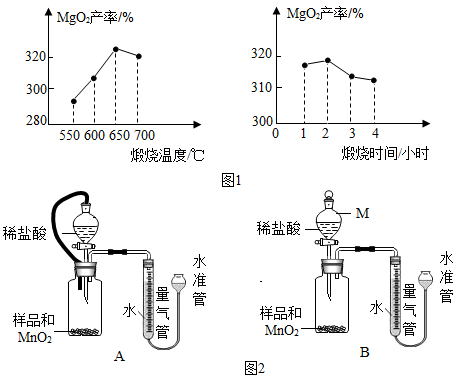
⒉转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O,温度升高,说明该反应热量(填“放出”或“吸收”).其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(产率= ×100%)的影响分别如图1所示,则最佳的煅烧温度为℃.
⒊分离:得到产品.
⒋测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O2体积,计算MgO2的质量分数.
已知:a.MnO2与稀盐酸不反应 b.MgO2+2HCl=MgCl2+H2O2
c.2MgO2 2MgO+O2↑ d.MgO+C
Mg+CO↑
①相同条件下,能使测定结果更准确.(填图2中“装置A”或“装置B”)
②经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是.(填序号)
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
MgCO3+Cl2+CO MgCl2+2CO2(设杂质不参加反应).生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)