流程一:从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,生产流程如图2所示: 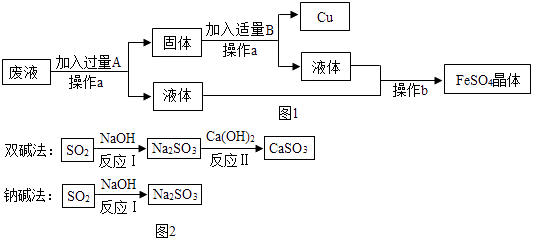
①CaSO3中Ca、S、O元素的质量比是.
②已知原料NaOH的价格为2.9元/kg.而Ca(OH)2的价格为0.36元/kg.两种工艺中,处理相同质量的SO2 , 双碱法所需的原料成本更低,其原因是.
【查阅资料】铬(Cr)是银白色、有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜.铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液…
铝是银白色、有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液…
【猜想与预测】三种金属在金属活动性顺序中的相对位置关系:①Cr、Al、Cu;②Al、Cr、Cu;③Al、Cu、Cr.
【实验验证】取大小相同的三种金属薄片,用砂纸打磨光亮(除去金属表面的氧化物)
实验一 | 实验二 | 实验三 | |
实验方案 |
|
|
|
实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色 | 无现象 |
|
结论 | 铬能与稀硫酸发生反应,反应速率较慢 | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
三种金属在金属活动性顺序中的相对位置关系是 (填序号) | |||
【反思交流】
【归纳提升】
1)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,如:Al、CrSO4溶液、Cu这三种药品.
2)比较金属活动性强弱的方法有:
①通过金属与酸反应,判断金属活动性强弱②通过金属与盐溶液反应,判断金属活动性强弱.
【陈璐实验】用铝片与铝粉分别和稀盐酸反应,发现反应快,方程式.
【魏松明实验】用镁粉与铝粉分别与稀盐酸反应,发现反应快.
韩俊洋实验】用镁条分别与10%稀盐酸、15%稀盐酸反应,发现反应快.
【徐庚辰实验】用镁条分别与10%稀盐酸、10%稀硫酸反应,发现稀盐酸反应快.
【实验结论】金属与酸溶液反应快慢与 金属的、金属颗粒的、酸的等有关.
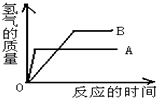
①A、B两种金属的活动性大小是;
②A、B两种金属的相对原子质量大小是;
③在三组Mg和Fe;Zn和Fe;Zn和Cu中,A、B可能是.
到H2 3g,假设H2被全收集到,则其中含铝g,该铝片中铝元素质量为g.