
广袤无际的自然界是一个碳的世界。碳在自然界中的循环变化,对于生态环境有极为重要的意义。随着工业生产的高速发展和人们生活水平的提高,排入大气中的CO2越来越多,导致温室效应增强。减少CO2排放,实现“碳中和”,已成为全球共识。
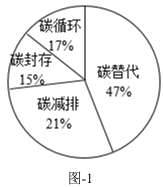
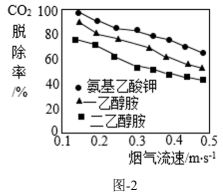
碳替代、碳减排、碳封存、碳循环是实现“碳中和”的4种主要途径。科学家预测,到2050年,4种途径对全球“碳中和”的贡献率如图-1。CO2的吸收是碳封存的首要环节,常选用氢氧化钠、氨水、一乙醇胺等作吸收剂。在研究膜吸收法吸收CO2时,研究人员通过实验比较了一乙醇胺、二乙醇胺、氨基乙酸钾3种吸收剂对烟气中CO2的脱除效果,其结果如图-2。
运用“碳捕捉与封存”技术,可以使CO2不进入大气。其中一种方法是将分离聚集的二氧化碳气体加压压入地下封存。被封存的CO2固体(即干冰)有许多用途,如用于食品保鲜、气体肥料、冷藏食物、物品灭火等,以此来消除资源的巨大浪费。我国正以超世界一流的目光发展经济,完善环保体制。
【项目一】家用燃料的合理使用
(一)燃烧燃料为了取暖
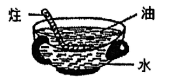
同学们经过走访调查,了解到从前人们把煤制成蜂窝煤后燃烧会更加充分(如图所示),请你从充分燃烧的角度解释这一现象。
【项目二】家用燃料的变迁和未来
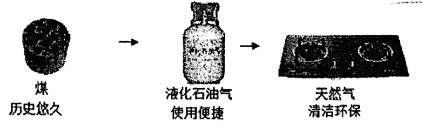
同学们查阅资料,了解到家用燃料的更新历程如图所示:
【验证结论】参加化学反应的各物质质量总和等于反应后生成的各物质质量总和
【制订计划】小立同学设计的实验装置和所用的药品如图A所示,小达同学设计的实验装置和药品如图B所示。

【实验结论一】小立同学通过上述实验得出和质量守恒定律一样的结论。
小达同学取下小烧杯并将其倾斜使小试管中的过氧化氢溶液进入小烧杯中,实验过程中发生反应的化学方程式是。反应结束后,再把小烧杯放回托盘天平上,天平平指针(填“偏左”、“偏右”或“指向分度盘中央”)。
小达认为该反应不遵守质量守恒定律故不能验证质量守恒定律,请判断他的结论是否正确:(填“是”或“否”)。
小立认为小达在验证质量守恒定律时,实验装置应,这样就能验证质量守恒定律了。
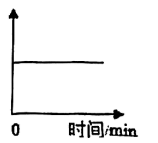
将化学实验图像化也是帮助我们深入理解原理的好方法。若用下图所示来记录小立同学的实验,则纵坐标不可以表示____。(填字母)
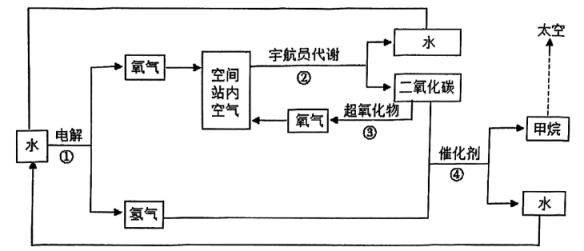
I.生命保障
为保证宇航员正常的生命活动,空间站内的空气需与我们周围的空气组成相近,主要采用以下循环系统:
①发射时C2H8N2与N2O4剧烈反应,生成二氧化碳、水和一种常见的气体单质,偏二甲肼与四氧化二氮反应过程中(填“吸收”或“放出”)热量。
②用液氢、液氧作推进剂时,为使两者恰好完全反应,则加注液氢、液氧的质量比为(最简整数比)。
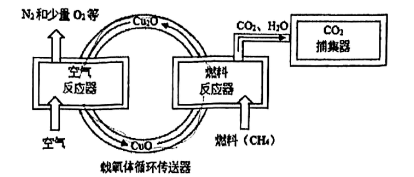
A.减少爆炸风险,更安全
B.消耗等质量甲烷,参加反应氧气较少
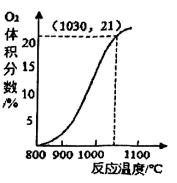
①在800~1100℃间,升高温度,排出的气体中N2体积分数(填“增大”或“减小”)。
②空气反应器中最适宜的反应温度范围是。(填序号)
A.800-900℃ B.900-1000℃ C.1000-1030℃ D.1030-1100℃