 B .
B . 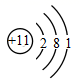 C .
C .  D .
D . 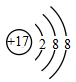
依据上文,回答下列问题。
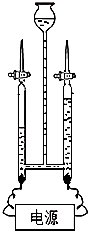
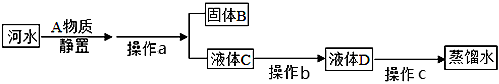
①A物质名称是 ,操作a名称是 。
②该同学为了将水中杂质除去,他选用装置Ⅲ,进行了操作b。装置Ⅲ中活性炭起作用是 。
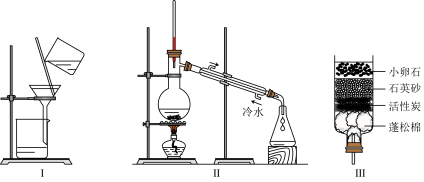
③该同学取少量液体D于试管中,加入少量肥皂水,振荡 ,发现有较多浮渣产生, 说明液体D是 水(填“硬水”或“软水”)。操作c应选用的装置是 (填序号),经过操作c以后,该同学重复上述实验 ,他观察到的实验现象应是 。
①可制氧气多少g?
②这些氧气在标准状况下为多少L?(O2的密度1.43g/L)