选项 | 叙述I | 叙述II |
A | | 用 |
B | | 可加热 |
C | | 可用 |
D | | |
| ① | ② | ③ |
| | | |
| 溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。 |
下列说法错误的是( )
 B .
B .  C .
C .  D .
D . 
| 烧杯编号 | ① | ② | ③ |
| 盛装的液体 |
|
|
|
| 加入的固体(质量相等) |
|
|
|
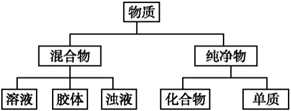
①将上述所举抗酸药填入表对应类别,属于盐的有,属于氧化物的有。
②写出CaCO3与胃酸反应的化学方程式:。

已知:杂质不溶于稀硫酸。
请回答下列问题:
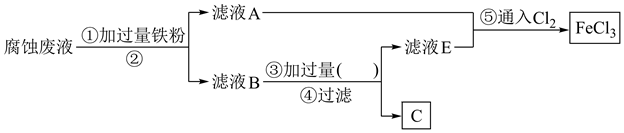
①滤液A中主要含有(填化学式,下同),滤渣B主要为。
②流程图中②的操作名称为,③处加过量的(填名称)。
③写出步骤⑤中反应的离子方程式:。
①补铁剂药片外层有糖衣包裹,糖衣的作用是。
②补铁剂中常添加维生素C,其作用之一是防止被氧化,由此推测维生素C具有性。
③若该补铁剂已经氧化变质,将其溶于水并滴加KSCN试剂会观察到。
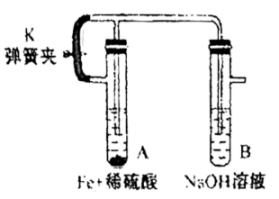
根据你的理解,请写出补全以下实验步骤。
①装配好试剂和装置后打开止水夹,使得A试管中反应产生的H:排净该装置中的空气(氧气)
②,以确定空气已经被排尽。
③,制备得到Fe(OH)2。
①被氧化的离子依次为:。
②对应的被氧化的离子的物质的量分别是:。
③对应氧化产物的物质的量分别是:。
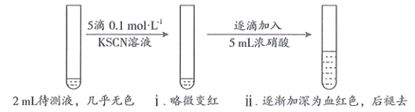
用KSCN检验 的原理是(用离子方程式表示)。
|
步骤 |
操作 |
现象 |
|
Ⅰ |
取2mL待测液,加入5滴0.1 | 溶液颜色无明显变化 |
| Ⅱ | 取2mL待测液, | 溶液变为红色 |
| Ⅲ | 向Ⅱ中所得溶液中逐滴加入5mL浓硝酸,边加边振荡 | 溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显 |
a.几乎未变质 b.部分变质 c.完全变质
从上述探究中获得启发,在用KSCN检验 及进行
还原性验证实验时,需要注意的事项有(至少2条)。