①可供给呼吸的气体。
②一种非金属氧化物。
③一种可溶于水的盐。
④一种可溶于水的碱。
①每年5月20日是“中国学生营养日”。正处于生长发育期的青少年每天需要摄入一定量的奶类、蛋类、蔬菜、水果等食物以保证营养均衡。牛奶、鸡蛋中富含的营养物质是(填选项序号之一)。
A.维生素C B.纤维素 C.淀粉 D.蛋白质
②长期使用的热水壶内壁上往往有一层水垢〔主要成分是CaCO3和Mg(OH)2〕,厨房中常用的下列四种物质中,可以通过浸泡将水垢除去的是(填选项序号之一)。
A.食用油 B.食醋 C.食盐 D.料酒
③我国是湿法冶铜的先驱。早在西汉的《淮南万毕术》中就有“曾青得铁则化为铜”之说,晋代的《抱朴子内篇》里也有铁置换铜的记载。请写出单质铁与硝酸铜溶液反应的化学方程式:。
④化学肥料的使用,使人类实现了由传统农业到现代农业的跨越。硝酸钾是一种重要的复合肥,它能同时均匀的供给作物多种养分。在硝酸钾中钾元素与氧元素的质量比为(填最简整数比),硝酸钾中氮元素的化合价显价。
①煤、石油和天然气等化石燃料都属于(选填“可再生”“不可再生”之一)能源。
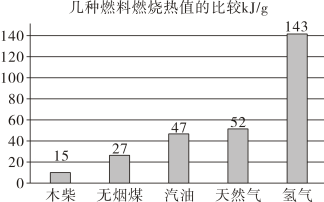
②结合下图信息判断,相等质量的图中五种物质充分燃烧时放出热量最多的是(填物质名称)。
③能源发展战略是全面贯彻生态文明思想,确保“双碳”目标实现的重要举措。下列措施中,不利于实现“碳达峰、碳中和”的是(填选项序号之一)。
A.倡导绿色低碳出行 B.增加花草绿植面积
C.大力发展燃煤发电 D.资源回收再利用
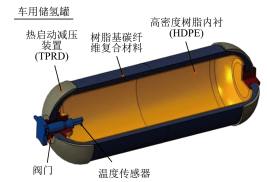
①氢能源公交车早已亮相泉城济南。氢能源公交车使用的氢氧燃料电池是一种将氢和氧的化学能转化成能的装置。

②写出氢能源的优点(两点即可):、。
①现有工业制氢方式中,甲烷二氧化碳重整制氢是一种重要工艺。在加热条件下,甲烷和二氧化碳发生化学反应,生成一氧化碳和氢气,请写出该反应的化学方程式:。
②理想的氢能源循环体系是利用合适的光分解催化剂,使水在太阳光的照射下分解产生氢气。若要制取9kg氢气,理论上至少需要分解水kg。

①聚乙烯〔〕属于(选填“金属”“无机非金属”“有机高分子”之一)材料。
②在聚对苯二甲酸丁二醇酯〔〕中质量分数最大的元素为(填元素名称)。
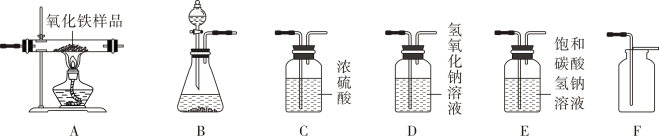
请根据题目要求,回答下列问题:
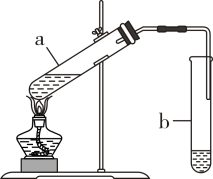
①所选仪器的连接顺序为(从左到右填写仪器序号字母)。
②上述方法制取二氧化碳的化学方程式为。
③向一个收集满二氧化碳气体的集气瓶中,同时放入一张干燥的蓝色石蕊试纸和一张湿润的蓝色石蕊试纸,观察到干燥的试纸不变色,而湿润的试纸变红。请叙述出现上述两种不同现象的原因:。
①该装置中,洗气瓶C的作用为。
②进行实验时,检查完装置的气密性,在仪器A硬质玻璃管中放入12g该氧化铁样品后,进行以下操作,其中应该先进行的是(填选项序号之一)。
a.用酒精灯加热 b.通入一氧化碳气体(含少量水蒸气)
③反应充分进行后冷却,测得此时洗气瓶C增重1.8g,洗气瓶D1增重6.6g,则12g该氧化铁样品中Fe2O3的质量分数为(计算结果精确至0.1%),该氧化铁样品中铁元素与氧元素的质量比为(填最简整数比)。
④从环保角度考虑,该套实验装置还存在明显的不足之处,你的具体改进建议是。
【探究与结论】
小明和小红经交流讨论后,认为利用物质溶解时溶液温度的变化也可以鉴别这两种物质,这是因为氯化钠固体溶于水,溶液温度无明显变化,而氢氧化钠固体溶于水,溶液温度(选填“升高”“降低”之一)。
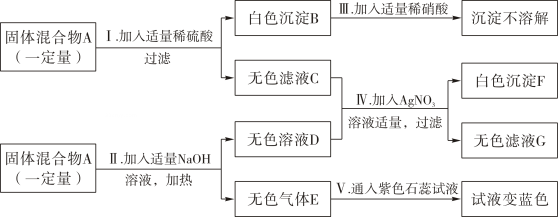
请根据实验过程和图示提供的信息,进行分析推理,回答下列问题:
①无色气体E为(填化学式);白色沉淀F为(填化学式)。
②写出步骤Ⅰ中发生反应的一个化学方程式:。
③在无色滤液G中,一定大量存在的阳离子是(填离子符号)。
④根据上述实验现象推断,在固体混合物A中,(NH4)2SO4(选填“一定存在”“一定不存在”“无法确定”之一),得出此结论的理由是。
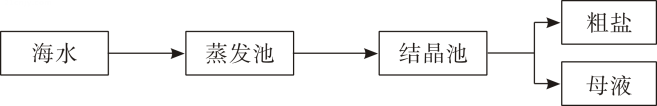
从上述流程可知,从海水中获得食盐是通过(选填“蒸发结晶”“降温结晶”之一)实现的。常温下,析出粗盐晶体后的母液,对于氯化钠来说是(选填“饱和”“不饱和”之一)溶液。

①当滴入NaOH溶液120g时(即图中B点),烧杯中溶液里一定大量存在的酸根阴离子是(填离子符号)。
②当滴入NaOH溶液80g时(即图中A点),恰好完全反应,此时所得溶液的质量是g。(只填计算结果,精确至0.1g)
③求该20gNaCl固体样品中NaCl的质量分数。(写出计算过程,结果精确至1%)