 C . 在上述流程中,中间体A还起到了吸水作用
D . 根据流程可知,DMC的结构为
C . 在上述流程中,中间体A还起到了吸水作用
D . 根据流程可知,DMC的结构为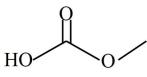

事实 | 解释 | |
A | 石墨晶体中横向与纵向的导电性不同 | 晶体性质表现自范性 |
B | CH4与NH3分子的空间构型不同 | 二者中心原子杂化轨道类型不同 |
C | H2O的热稳定性比H2S强 | H2O分子间形成氢键,而H2S分子间没有形成氢键 |
D | 向盛有硫酸铜蓝色溶液的试管里加入过量氨水,得到深蓝色溶液 | NH3与Cu2+间的配位键比H2O与Cu2+间的配位键强 |

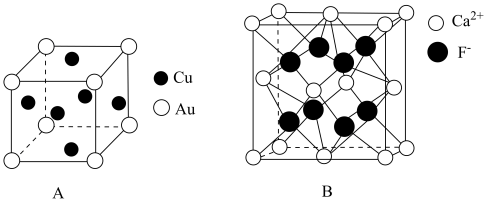
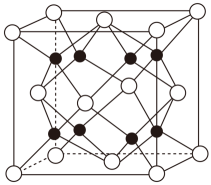
①该晶体中金属原子之间的作用力为。
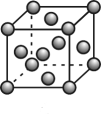
②该晶体具有储氢功能,氢原子可进入到由Cu原子和Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与(如图B)的结构相似,该晶体储氢后的化学式为。
③已知该合金密度为 , 铜的原子半径为127.8pm,阿伏加德罗常数值为NA , 则Au原子半径r(Au)= =pm(列出计算式)。
①中
的配位数为。
②配体中心C原子的杂化方式为:。
③O、N、S三种元素的电负性由大到小的顺序为。

①该晶体中原子个数比为:。
②若晶胞参数分别为a、b
、c
, 阿伏加德罗常数的值为
, 则晶体的密度为
(列出计算表达式)。
 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯(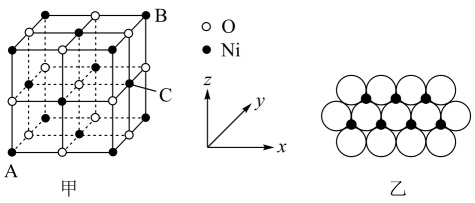
①白磷()是分子晶体,易溶于
, 难溶于水,说明白磷和
都是分子(填“极性”或“非极性”)。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。
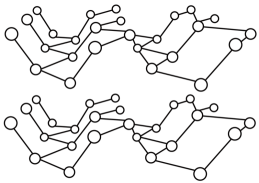
下列有关黑磷晶体的说法正确的是(填字母序号)
A.黑磷晶体中层与层之间的作用力是分子间作用力
B.黑磷晶体中磷原子杂化方式为杂化
C.黑磷晶体是混合型晶体
D.黑磷晶体的每一层中磷原子都在同一平面上

①氨水中的微粒存在的化学键有(填标号)。
A.极性键 B.非极性键 C.氢键 D.键 E.
键
②中配体是,
所含元素中电负性最大的非金属元素是 (填元素符号)。
③中含mol
键。

①在水中可以电离出配离子
, 该配离子中的配体是,该配离子中含有的
键与
键的数目之比是。
②依据观察到的实验现象说明和
的性质不同,原因是。

①CuS晶体中,铜离子与硫离子间的最短距离为pm。
②晶体的密度为
(列出计算式即可)。



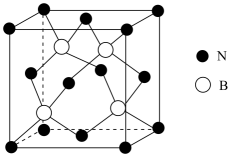
①立方氮化硼熔点比金刚石低,原因是。
②一个N原子周围紧邻的N原子有个。
③晶体中含有配位键,提供空轨道的原子是原子。
④若晶胞参数为α nm,设阿伏加德罗常数的值为NA , 则晶体的密度为g/cm3(用含α、NA的表达式表示)。