温度 | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.7 | 35.8 | 36 | 36.5 | 37 |
碳酸钠 | 6 | 16 | 18 | 36.5 | 50 | |
硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |

【查阅资料】相关金属离子开始沉淀至完全沉淀的pH范围如下表所示:
Fe3+ | Al3+ | Zn2+ | Cd2+ | |
开始沉淀 | 2.7 | 3.4 | 6.5 | 7.4 |
沉淀完全 | 3.7 | 4.7 | 8.5 | 9.4 |
车内空气质量的改善
随着社会经济的高速发展,汽车在人们日常生活中的地位越来越重要。人们在关注汽车的操控性、经济性、安全性的同时,车内空气质量也日益成为人们关注的焦点问题。
车内空气污染主要来源于车内材料以及车外污染物的侵入,其主要污染物如下表所示。
污染来源 | 涉及污染物 | |
车内材料 | 汽车内饰 | 苯(C6H6)、甲苯(C7H8)、甲醛(CH2O)等 |
空调 | 空调吸收物、细菌、霉菌 | |
车外环境 | 空气 | PM2.5粉尘、细菌、霉菌、病毒 |
CO、NOx等有毒气体 | ||
为改善车内空气污染,各类车内空气净化技术、产品陆续被各供应商和主机厂进行开发和搭载。目前主要有以下三种技术:活性炭滤网技术、光触媒净化技术以及抗菌涂层技术。
①活性炭滤网技术:通过在空调滤网内喷涂活性炭层,对进入车内的空气进行净化。
②光触媒净化技术:光触媒(TiO2)因其稳定性好,功效持久,不产生二次污染等特点,在空气净化领域已经早有应用。光触媒一般以TiO2材料作为催化剂,在特定波长段的光照下,产生氧化能力极强的羟基自由基,对于甲醛净化具有良好放果,净化原理见图1。

③抗菌涂层技术:氧化锌和银离子是两种应用较多的抗菌涂层材科。但银离子不适合长期储存,高剂量对人体具有毒性,因此,氧化锌具有更为广泛的应用前景。氧化锌的杀菌机理与光触媒技术类似,其杀菌原理见图2。
每种空气净化技术所对应的净化对象和净化能力都各有差异,只有多种技术相结合,互为补充,才能更加全面和彻底地改善车内空气质量。
a.甲苯 b.NOx c.CO
茶树适宜在pH为5~6的土壤中生长,土壤呈(填“酸性”或“碱性”)。
选择茶具:现选用三种不同材质的茶具泡某品牌龙井茶,测量茶汤中风味物质儿茶素类和咖啡碱的含量。测量结果如下:
浸泡时间(min) | 儿茶素类含量(mg/g) | 咖啡碱含量(mg/g) | ||||
紫砂壶 | 瓷质盖碗 | 玻璃杯 | 紫砂壶 | 瓷质盖碗 | 玻璃杯 | |
2 | 155 | 162 | 151 | 25 | 26 | 26 |
4 | 201 | 223 | 214 | 32 | 36 | 35 |
以下属于该实验需控制的变量是(填字母)。
a.水温 b.水量 c.水样 d.煮水方式 e.茶叶用量
选择水:茶汤的滋味和香气与水的酸碱度和矿化度有较大关系。经研究发现水的pH值越低,茶汤的品质越高:水的矿化度(钙、镁离子含量)越低,茶汤的品质越高。选取三种不同水样测量,结果见下表。三种水祥中最适合泡茶的是。
水样 | 虎跑泉水 | 当地自来水 | 某品牌纯净水 |
pH | 5.76 | 6.92 | 6.81 |
矿化度 | 低 | 高 | 低 |
长期使用的茶具中易出现茶垢(主要成分为碳酸钙),需定期清理。
除垢原理
牙膏除垢:牙膏中有摩擦剂,利用摩擦作用,达到去污效果。
柠檬酸除垢:柠檬酸溶液能除垢的原因是。
茶垢清洁剂除垢:茶垢清洁剂中的过碳酸钠遇热水产生大量气体,分解茶垢。
①现有50g质量分数为40%的柠檬酸溶液,将其稀释为除垢所需的质量分数为10%的柠檬酸溶液,需加水g。
②用碳酸钠和30%的过氧化氢溶液为主要原料制备过碳酸钠(2Na2CO3·3H2O2),理论上碳酸钠与过氧化氢溶液投料的质量比为;实际制备时该比值会偏低,主要原因是。
由如图可知:锂原子内的质子数是,锂离子的符号为。与早期电池用锌相比,锂的相对原子质量和体积都更小,作为电池材料具有更高的能量密度。锂电池内发生的某个反应可表示为: , 反应前后氧元素化合价不变,则反应后锰元素的化合价是。

向经过处理的盐湖水(主要成分是NaCl、LiCl)中加入碳酸钠,产生碳酸锂沉淀,写出该反应的化学方程式:,过滤、洗涤、干燥后得到碳酸锂晶体。请你设计一个实验确认晶体已洗涤干净:。
锂电池中的正极材料是钴酸锂(LiCoO2),钴是一种重金属元素,将其回收的流程如下(杂质不参与反应):
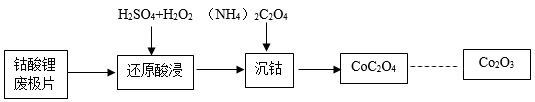
废极片中钴酸锂(LiCoO2)的质量分数为98%,若反应过程中钴元素无损耗,则1kg钴酸锂废极片最终能回收得到Co2O3的质量为。(写出计算过程)
a.节约金属资源
b.有利于推动相关企业提高电池高效再生技术
c.防止废电池中的重金属元素对土壤和水造成污染