“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵,再加热碳酸氢钠即可制得纯碱。
纯碱属于(填“酸”“碱”或“盐”)。②Na2CO3在水中全部解离出Na+和。
③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
【提出猜想】猜想一:H2O单独起作用,产生较多的OH- , 使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH- , 使溶液呈碱性。
猜想三:和H2O作用,产生较多的OH- , 使溶液呈碱性。
【实验探究】
|
实验操作 |
实验现象 |
实验结论 |
|
A.向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液 |
溶液无明显变化 |
猜想一不成立 |
|
B.向试管中加入一定量的NaCl溶液,滴入2滴酚酞溶液 |
溶液无明显变化 |
猜想二不成立 |
|
C.①向试管中加入一定量的Na2CO3溶液,滴入2滴酚酞溶液 ②往①所得溶液中逐滴加入CaCl2溶液至过量 |
①溶液由无色变红色 ② |
猜想三成立 |
写出实验操作C中步骤②发生反应的化学方程式:。
【解释与结论】同学们和老师交流,得知碳酸钠中的和H2O作用,产生较多的OH-和
, 从而形成氢氧化钠和碳酸氢钠
结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:Na2CO3与水作用的化学方程式:。
Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
溶质质量分数 |
2% |
2% |
2% |
6% |
6% |
6% |
10% |
10% |
10% |
|
溶液温度(℃) |
20 |
40 |
60 |
20 |
50 |
60 |
20 |
40 |
70 |
|
溶液pH |
10.90 |
11.18 |
11.26 |
11.08 |
11.27 |
11.30 |
11.22 |
11.46 |
11.50 |
【解释与结论】实验①、②、③对比,可得出的结论是。
下列物质可用于去油污的是____(填字母)。
科学家已经研究出多种方式来实现二氧化碳的转化。例如我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。利用二氧化碳和氢气作为原料在纳米纤维催化剂的作用下,生成甲醇(CH3OH)和水,请写出该反应的化学方程式。
化学链燃烧技术是利用载氧体(金属氧化物)将空气中的氧传输至燃料的新技术,利用化学链燃烧技术捕捉甲烷(CH4)燃烧所产生的CO2 , 再利用NaOH溶液喷淋捕捉CO2的工艺流程图如下:
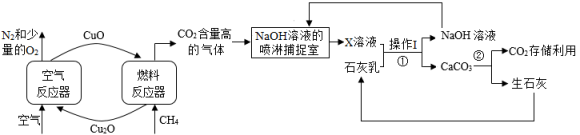
氧元素的质量分数:Cu2OCuO(填“>”“<”或“=”)

配制上述实验所用的氢氧化钠溶液: