A | B | C | D | |
装置 |
|
|
|
|
目的 | 干燥CO2 | 提纯乙酸乙酯 | 发生铝热反应 | 制取Cl2 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液
在25℃和101kPa时,Na与反应生成
放出510.9kJ的热量,写出该反应的热化学方程式:。
配平上述离子方程式。
该反应说明具有(选填“氧化性”“还原性”或“漂白性”)。

空气反应器与燃料反应器中发生的发应分别为:
①
②
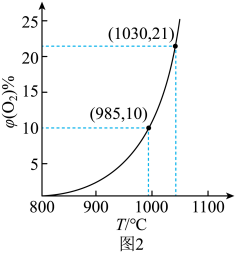
往盛有载氧体的刚性密闭容器中充入空气[氧气的物质的量分数
为21%],发生反应①。平衡时
随反应温度T变化曲线如图2所示。
载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的载氧体,反应②的反应历程如图3。

称取100g土壤于烧杯中,加入足量浓硫酸和一定量的催化剂,充分反应后过滤、洗涤滤渣,往滤液加入足量NaOH溶液,按如图进行蒸馏,用过量硼酸吸收生成的氨。

已知:常温下,
土壤中的氮元素主要存在形式。(填微粒符号)
将锥形瓶内溶液稀释至250mL,取出25.00mL稀释液,向其中滴加2~3滴甲基红(变色范围4.4~6.2),用盐酸标准溶液滴定。重复实验3次,平均消耗盐酸标准溶液18.00mL。
滴定时,发生反应的离子方程式为。