中国是“茶之国”,喝茶已有四千多年的历史。茶叶中含有多种生物碱,咖啡因(C8H10N4O2)是其中之一,咖啡因具有刺激心脏、促进血液循环及兴奋大脑等作用。
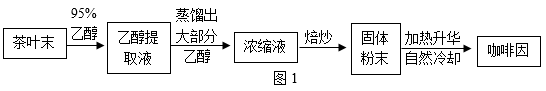
从茶叶中提取咖啡因的过程,如图1。
咖啡因能溶于水,可使用分光光度法比较不同茶叶水提物中咖啡因的含量,结果如表1.吸光度值越高,咖啡因含量越高。
表1四种茶叶咖啡因吸光度值
| 茶叶品种 | 铁观音 | 滇红茶 | 白毫银针 | 龙井 |
| 吸光度值 | 0.076 | 0.103 | 0.123 | 0.047 |
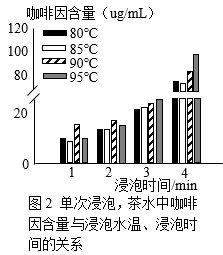
实验人员使用信阳毛尖、控制茶叶与水的质量比为1:75进行其他研究,结果如图2、3。
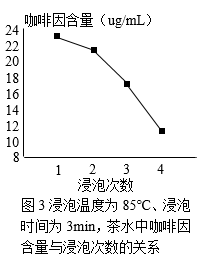
咖啡因摄入过多容易刺激胃肠道,引起骨质疏松等,生活中应将其摄入量控制在合理范围内。
依据文章内容回答下列问题。
①由图2可知,单次浸泡、浸泡时间相同时,温度在80~95℃范围内,浸泡温度越高,茶水中咖啡因含量越高。
②咖啡因摄入过多对人体有害。
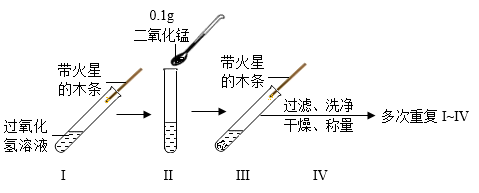
H2O2分解的化学方程式为。
【进行实验】
称取催化剂置于三颈瓶中,塞紧胶塞,用注射器将3mL5%过氧化氢溶液快速注入。测定氧气浓度达到最高值时所用的时间,实验记录如下:

| 序号 | 初始温度/℃ | 催化剂种类 | 催化剂质量/g | 氧气浓度达到最高值时所用时间/s |
| ① | 30 | MnO2 | 0.03 | 8 |
| ② | 30 | FeCl3 | 0.03 | 32 |
| ③ | 30 | FeCl3 | 0.04 | 29 |
| ④ | 30 | FeCl3 | 0.05 | 28 |
| ⑤ | 30 | CuCl2 | 0.03 | 3364 |
| ⑥ | 30 | CuCl2 | 0.04 | 837 |
| ⑦ | 30 | CuCl2 | 0.05 | 464 |
注:①氧气浓度达到最高值时H2O2已完全分解。
②在可控范围内,过氧化氢分解速率越快,催化效果越好。
【解释与结论】
实验2中,效果最好的催化剂是。
继续实验,发现活性炭比MnO2的催化效果差。其实验方案:称取0.03g活性炭置于三颈瓶中,塞紧胶塞,用注射器将3mL5%过氧化氢溶液快速注入。在初始温度30℃时测定,测定结果是。