D .
D .  B .
B .  C .
C .  D .
D . 
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
Ⅰ.取少许原溶液,滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许原溶液,滴入溶液,无白色沉淀产生。
Ⅲ.取少许原溶液先滴加稀硝酸,再滴入溶液,产生白色沉淀。
Ⅳ.取少许原溶液,滴入少量溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是;肯定存在的离子是。
②若原溶液中各种离子的浓度相等,确定该溶液中(填“有”或“无”) , 判断依据是。
③若原溶液中各离子的浓度相等,取一定量该溶液,加入等体积的稀硫酸(其中硫酸根浓度与原溶液中各离子浓度相等),写出发生反应的离子方程式:。
“84”消毒液 有效成分 NaClO 规格 1000mL 质量分数 25% 密度 |
请回答下列问题:


请回答下列问题:
①受热易升华,冷却后易凝华;
②遇剧烈反应。
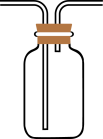
为收集D中产物,在D与E之间,除增加收集装置外,还需要增加装置。如果使用如图的收集装置,可能存在的安全问题是。