(如图所示),下列说法正确的是( )

①氧元素。
②2个氢原子。
③镁离子。
④氧化铜中铜元素为+2价。
①生活中常见的金属单质。
②常用作溶剂的氧化物。
③能造成大气污染的化合物。

①重铬酸钾(K2Cr2O7)属于(选填“单质”、“氧化物”、“化合物”、“混合物”中的一项)
②乙醇(C2H5OH)分子中,碳、氢的原子个数比为(填最简整数比)。
③乙醇(C2H5OH)中,质量分数最大的元素为。

①接通直流电源一段时间后,将燃着的木条放在b玻璃管口,打开活塞,气体燃烧,火焰呈淡蓝色,该气体是;写出电解水的文字表达式为。
②由上述实验可以得出:水是由(填元素名称)元素组成的。
③水通电分解时没有发生变化的是(选填序号之一)。
A.水分子的结构 B.氢原子和氧原子 C.水分子的能量
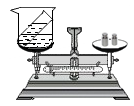
①确定研究对象:可以选择的化学反应是。(选填序号之一)
A.盐酸和大理石反应,生成氯化钙、水和二氧化碳
B.氢氧化钠溶液和硫酸铜溶液反应,生成硫酸钠和氢氧化铜
②进行实验:反应前后天平指针不发生偏转。
③得出结论:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
④迁移应用:下列现象能用质量守恒定律解释的是(答案合理均选)。
A.镁条燃烧时,生成的白色粉末的质量大于镁条质量
B.氢气燃烧时,参加反应的氢气和氧气的体积大于生成水的体积


①操作I的名称是,操作Ⅱ需要向液体C中加入活性炭,利用其性除去液体C中的颜色和异味。
②分离下列混合物,可以利用操作Ⅲ达到目的的是(选填序号之一)。
A.从海水中获得氯化钠 B.除去酒精溶液中的水 C.除去铜粉中的铁粉
③小明在参观本市自来水厂时,看到自来水的生产过程中有加入液氯(Cl2)的环节,该环节的作用是(选填序号之一)。
A.杀菌消毒 B.去除固体杂质 C.去除可溶性矿物质

①计算:需要氯化钠固体g,水mL(水的密度为1.0g/cm3);
②称量:用托盘天平称取氯化钠固体,需要把氯化钠放在托盘里的纸上称量。称量过程中发现托盘天平指针向右偏转,此时应(选填序号之一)。
A.调节平衡螺母
B.减少右盘中砝码
C.减少左盘中食盐
D.增加左盘中食盐
量取:用规格为mL(填“10”、“50”或“100”之一)的量筒量取所需要的水。
若在量取水时俯视读数,其它操作均正确,则会造成所配制氯化钠溶液的溶质质量分数(填写“偏大”、“偏小”或“无影响”之一)
③溶解:将量好的水倒入盛有氯化钠的烧杯中,并用玻璃棒搅拌,其目的是。
④装瓶保存。
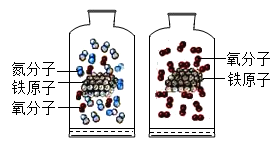
①实验室用过氧化氢溶液和二氧化锰固体制取氧气的文字表达式为,若不加入二氧化锰,则会导致。
②已知常温常压下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,水溶液显碱性。实验室可以利用氯化铵(固体)和氢氧化钙(固体)混合加热制备氨气,应选择的气体发生装置是。(选填字母序号),收集氨气应选用的装置是(选填字母序号)
③确定实验室制取气体的反应原理时,下列因素中不需要考虑的是(选填序号之一)。
A.药品容易获得,能生成所要制取的气体
B.反应条件易于控制,反应速率适中
C.操作简便易行,安全可靠,节能环保
D.所要制取气体的颜色
④下列关于氧气的认识中正确的是(选填序号之一)。
A.氧气支持燃烧体现了氧气的物理性质
B.物质与氧气发生的化学反应都是化合反应
C.呼吸作用和铁生锈均属于缓慢氧化
D.绿色植物作用是使自然界中的氧原子总数增加
【提出问题】污渍爆炸盐(如图)溶于水,产生气体的成分是什么?

【形成假设】
①该气体可能是CO2、O2、H2、N2。
②根据爆炸盐的有效成分推测,该气体中不可能含有N2 , 因为。
③从使用安全角度考虑,该气体中应该不含有H2 , 因为。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
实验编号 | 实验操作 | 实验现象 |
I | 将该气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
Ⅱ | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
【形成结论】
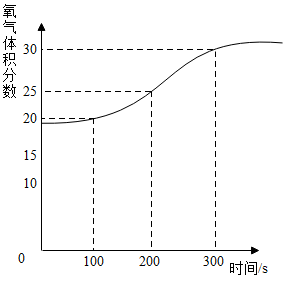
①由实验I可知,该气体中肯定含有。
②为了进一步确定是否产生了O2 , 老师利用氧气传感器测得爆炸盐溶于水前后容器内O2的浓度变化如图所示,证明该气体中(填“有”或“没有”)氧气。

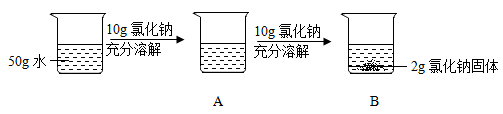
①A处溶液是氯化钠的溶液(选填“饱和”、“不饱和”、“无法确定”之一)。
②A处溶液中大量存在的金属阳离子是(写离子符号)。
③20℃时,B处所对应的氯化钠溶液的质量为g(计算结果精确到0.1g)。
④若用溶质质量分数为18%的氯化钠溶液配制500g溶质质量分数为0.9%的生理盐水,需18%的氯化钠溶液多少克?(请写出具体计算过程,计算结果精确到0.1g)
①已知葡萄糖的化学式为(C6HxO6),其化学式量为180,则x的数值为,葡萄糖中碳元素质量分数为(计算结果精确到0.1%)。
②若注射500g溶质质量分数为5%葡萄糖注射液,则进入体内的碳元素质量为克。(请写出具体计算过程,计算结果精确到0.1g)