①
②
③
④
⑤
a.臭碱(Na2S) b.小苏打(NaHCO3) c.水玻璃(溶液)
实验前首先要进行的操作是。
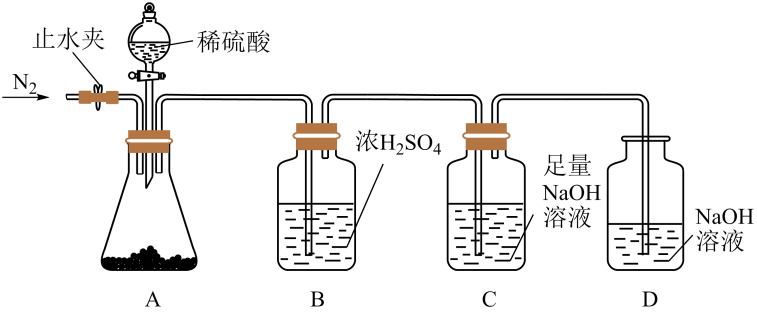
①两次通入的目的分别是、。
②混合物中的质量为g。

资料:沉淀池中的反应为。
操作1的名称为;煅烧炉中反应的化学方程式为。
a.还原性 b.氧化性 c.酸性

①写出装置A中反应的离子方程式:。
②装置B、C中盛放的试剂分别是、;装置F的作用是。
③装置E的实验目的是验证氯气是否具有漂白性,为此E中Ⅰ、Ⅱ、Ⅲ应依次放入(填字母)。
选项 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰(氧化钙和氢氧化钠的混合物) | 硅胶(具有吸水性) | 浓硫酸 | 无水氯化钙(具有吸水性) |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
④若进行实验时E中发生堵塞,此时B中的现象为。