A | B | C | D |
|
|
|
|
粮食酿酒使用的缸 | 新疆棉制品衬衫 | 冰糖 | “飞扬”火炬中的聚硅氮烷树脂 |



![]()
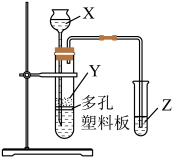
实验室中现有药品:①稀盐酸、②稀硫酸、③NaHCO3固体、④CaCO3固体、⑤Na2SiO3溶液,请选择合适药品利用上述装置设计实验验证C、Si的非金属性的变化规律;装置X、Y、Z处所盛装或放置的药品分别为、、(填序号)。但有同学认为该实验所得现象无法充分证明C、Si的非金属性强弱,如何改进?。
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl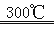 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1100℃反应制得纯硅,已知SiHCl3能与H2O强烈反应,在空气中易自燃.
请回答下列问题:
用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
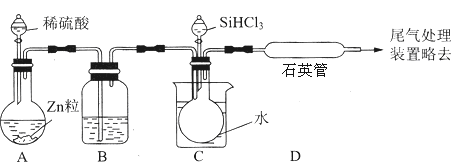
①装置B中的试剂是 .装置C中的烧瓶需要加热,其目的是 .
②反应一段时间后,装置D中观察到的现象是 ,装置D中发生反应的化学方程式为 .
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 .
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.

实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2 , 选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为 ,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为。
【提出假设】假设1:有;假设2:有
;假设3:……
【设计方案】取少量吸收液于试管中,滴加稀硫酸至溶液略呈酸性,然后进行如下实验:
Ⅰ、向吸收液中滴加淀粉KI溶液,若溶液变为,可验证假设1成立。
Ⅱ、向吸收液中(简述实验操作和实验现象),可验证假设2成立。