![]()
吸附罐中固体颗粒的主要作用是吸附杂质,固体颗粒可选用。


①一定条件下由A生成C的符号表达式为。AB
C的变化过程中,不变的是。
②参照如图微粒表示方法,面出“氢氧基团(OH)和氢(H)结合成水分子”的微观示意图:。
方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃~-183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温,加压条件下,使之转化为液态,储存于钢瓶里。
从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是。
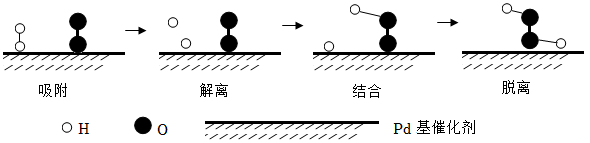
“解离”时,结构被破坏的分子是(填化学式)。
ⅰ.小组同学不加催化剂,在不同温度下,用不同浓度的H2O2进行实验,记录实验现象如下表1。
表1探究温度、反应物的浓度对反应速率的影响
50℃ | 60℃ | 70℃ | |
5%(H2O2) | 无明显气泡 | 无明显气泡 | 极少量气泡 |
10%(H2O2) | 无明显气泡 | 无明显气泡 | 少量气泡 |
15%(H2O2) | 无明显气泡 | 少量气泡 | 较多气泡 |
由表1可知: 温度或反应物浓度可加快 H2O2的分解。
资料:常见可溶性氯化物在水溶液中大都是以阳离子和氯离子形式分散的。
表2探究氯化物对反应速率的影响
实验1 | 实验 2 | 实验 3 | |
氯化物的种类 | NaCl | MgCl2 | CuCl2 |
氯化物的质量 | 0.1 g | a g | 0.1 g |
放出氧气的体积/mL | 2.0 | 4.0 | 420.0 |
双氧水的分解率/% | 0.30 | 0.60 | 63.18 |
在表2中,a的值为;
用双氧水可制得“钙多宝”。“钙多宝”主要成分是CaO2 , 常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主要杂质是Ca(OH)2和CaCO3。
请用符号表达式说明出现上述杂质的原因:;。
高锰酸钾为紫黑色晶体,有毒,对人体组织器官一定的腐蚀性,具有强氧化性,其稀溶液为浅紫红色,能与维生素C反应得到无色溶液。高锰酸钾在酸性环境中会缓慢反应生成二氧化锰、钾盐和氧气,且光对这种分解有催化作用。
高锰酸钾遇有机物时即释救出初生态氧,初生态氧即游离态的氧原子,具有极强的氧化性,作用于子菌体蛋白,破坏其结构,从而使之死亡。高锰酸钾杀菌所需浓度较低,0.01%-0.1%作用 10-30分钟可杀灭细菌繁殖体、病毒和破坏肉毒杆菌毒素,过氧化氢溶液杀菌的原理类似于高锰酸钾,但高锰酸钟抗菌除臭作用比过氧化氯溶液强而持久,其杀菌力随浓度升高而增强。 0.1%时可杀死多数细菌的繁殖体,2%-5%溶液能在24小时内可杀死细菌。在酸性条件下可明显提高杀菌作用,如在1%溶液中加入11%盐酸,能在 30 秒钟内杀死炭疽芽孢。
工业上可用二氧化锰和氢氧化钾为原料,经熔融、氧化、电解等环节生产高锰酸钾。
①实验前,要在试管口放置一小团蓬松的以防止;高锰酸钾受热分解的符号表达式为。
②加热高锰酸钾后的试管内壁上往往有棕色物质,很难刷洗干净。所以除了用酸性物质清洗以外,还可以用洗涤沾有高锰酸钾的试管。
③在实验室里,高锰酸钾常用的保存方法是。

①在氧化室中,除了二氧化锰和氢氧化钾外,还有参与发应,此反应还生成水,则反应的符号表达式为。
②为了实现电解室中的反应,还需要提供含元素的反应物,该过程的能量转化形式是。
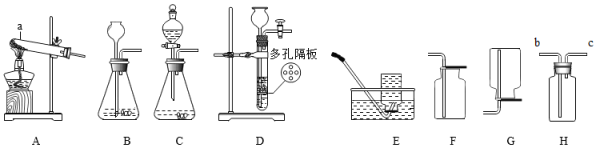
①应选择的药品是(填下列字母序号)。
a.氯酸钾和二氧化锰 b.过氧化氢溶液和二氧化锰
②应选择的装置组合是从上述实验装置“A-G”中选择)。
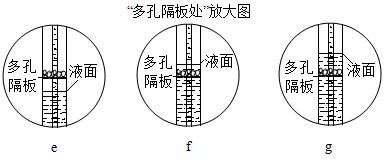
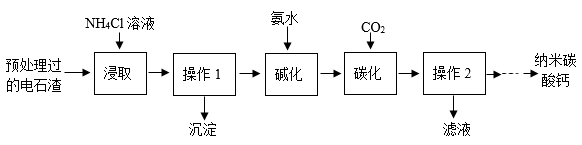
已知:①氨水中含有氨气、水以及NH3·H2O,且NH3·H2O受热易分解。
②“浸取”时的主要反应为;
③“碳化”时的主要反应为。


温度 | 反应液浑浊所需时间(单位:秒) | 反应完全所需时间(单位:分钟) |
20℃ | 480 | >180 |
40℃ | 120 | 180 |
60℃ | 1 | 50 |
80℃ | 1 | 68 |
实际碳化反应的温度采用了60℃,理由是、。