编号 | 时间/min c(NH3)/(10-3mol•L-1) 表面积/cm2 | 0 | 20 | 40 | 60 | 80 |
① | a | 2.40 | 2.00 | 1.60 | ||
② | a | 1.20 | 0.80 | 0.40 | x | |
③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |

实验操作 | 目的 | |
A | 振荡注射器,无明显现象 | 验证NO不溶于水 |
B | 打开弹簧夹,快速吸入10mL空气后,夹上弹簧夹,无色气体变为红棕色 | 证明可发生反应:2NO+O2=2NO2 |
C | 再次振荡注射器,气体颜色逐渐变浅至无色,注射器活塞向内移动 | 证明可发生反应:3NO2+H2O=2HNO3+NO |
D | 再打开弹簧夹,快速吸入空气至活塞位置处于最大刻度处,夹上弹簧夹,充分振荡注射器后静置,直至无明显现象为止 | 将注射器中的NO完全转化为HNO3 |

主反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H1=+41.2kJ•mol-1
①CO、H2生成CH3OH的热化学方程式是。
②提高CH3OH在平衡体系中的含量,可采取如下措施:(写出两条即可)。
a.CO的物质的量不再发生变化
b.CO与H2的物质的量浓度相等
c.n(CO)∶n(H2O)∶n(CO2)∶n(H2)=1∶1∶1∶1
d.v正(CO)=v逆(H2O)
i.4H2O(g)+3FeCl2(s)=Fe3O4(s)+6HCl(g)+H2(g) △H1
ii.Fe3O4(s)+8HCl(g)=FeCl2(s)+2FeCl3(s)+4H2O(g) △H2
iii.2FeCl3(s)=2FeCl2(s)+Cl2(g) △H3
iv. △H4
反应i~iv循环可分解水,可利用△H1~△H4计算2H2O(g)=2H2(g)+O2(g)的△H。在横线处写出反应iv的化学方程式 。
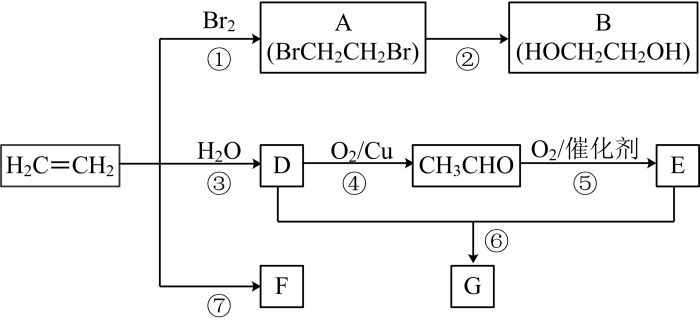
已知:2CH3CHO+O22CH3COOH
制法一:实验室用D和E反应制取G,装置如图1所示。

i.关于该实验的说法错误的是(填序号)。
a.甲中加入几片碎瓷片可以防止暴沸
b.乙中导管不伸入液面下是为了防止倒吸
c.甲中加入过量D,可使E的转化率达到100%
d.实验结束,乙中液体上层为无色透明的油状液体
e.乙中的饱和Na2CO3溶液可以用NaOH代替
ii.反应⑥的化学方程式是,反应类型是。
iii.分离出试管乙中油状液体的方法是。
制法二:工业上用CH2=CH2和E直接反应获得G。
iv.直接反应获得G的化学反应方程式是。
v.与制法一相比,制法二的优点是。
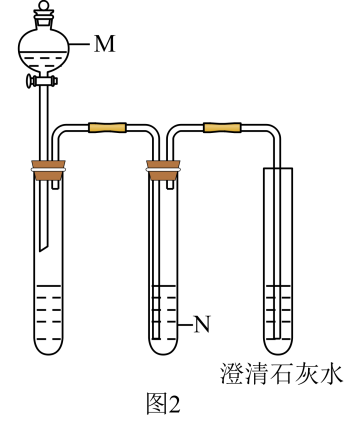
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、
(紫色)
ii.浓碱条件下,可被OH-还原为
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱

序号 | 物质a | C中实验现象 | |
通入Cl2前 | 通入Cl2后 | ||
I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
III | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
a.NaCl b.FeCl2 c.Na2SO3 d.NaOH e.H2SO4
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为
①用离子方程式表示可能导致溶液碱性减弱的原因,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为,溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量。
③取III中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深的原因是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。

已知:i.FeS2与稀硫酸不反应;
ii.Fe3+通过反应I、反应II被还原,反应I为:2Fe3++FeS2=2S+3Fe2+。
_FeS2+_Fe3++_H2O=_Fe2++_SO+_。
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
离子 | 还原前浓度(mol•L-1) | 还原后浓度(mol•L-1) |
Fe2+ | 0.10 | 2.50 |
3.50 | 3.70 |
反应I、II中生成的Fe2+的物质的量之比为。
②“沉淀”工序中所得沉淀需充分洗涤,检验沉淀是否洗净的方法是。
样品中FeCO3质量分数的计算式为(用质量分数表示)。