①碳减排:家用燃料低碳化和使用氢能源等可以有效减少CO2的排放。电解水制氢的成本是煤制氢的4~5倍,煤制氢更具成本优势。某工厂以煤(主要含碳元素并含有少量的硫)为原料制氢流程如下:
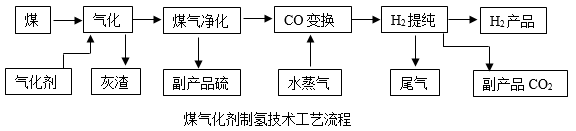
煤气化时主要转化为CO,则气化剂中一定含元素。若副产品CO2直接排放,是否能实现碳中和,你认为(填“是”或“否”),理由是。
②碳“捕捉”与封存:利用一些物质来吸收空气或废气中的CO2 , 然后将富集的CO2转换为“超临表体”并缓慢固化。高压低温下,气态CO2变为固态过程中,发生变化的是(用微粒观点解释)。
③碳转化:一定条件下,可将CO2和氢气在催化剂表面转化成有机清洁燃料甲醇(CH3OH)和水,该反应的化学方程式为。
a.颜色 b.气味 c.密度 d.溶解性

【查阅资料】“脱氧剂”一般由还原铁粉、活性炭和氯化钠等组成。
如下图1所示装置,请写出检验图1反应装置的气密性方法步骤:。甲同学称取1.0g样品,加入锥形瓶中,并称量反应前装置和药品的总质量为m1 , 打开分液漏斗活塞,将过量的稀盐酸加入锥形瓶中。

乙同学认为甲同学的方案误差较大,于是设计如图2的方案。甲同学误差较大的原因是(填字母)。
a.干燥剂吸收了空气中的水蒸气
b.稀盐酸与铁反应放热
c.装置内气体反应前是空气,反应后是氢气,质量相差较大