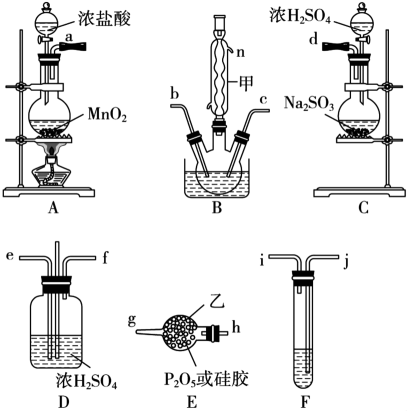
| A | 比较 | |
| B | 配制 | |
| C | 探究石灰石与稀盐酸在密闭环境下的反应 | |
| D | 淀粉在不同条件下水解 | |


①能说明容器中的反应均已达到平衡状态的是。
A.容器内气体的平均相对分子质量不变 B.和
的转化率相等
C.与
的物质的量之比保持不变 D.
②根据反应过程中压强(p)和时间(t)的关系图可知,0(填“>”“<”或“不确定”)。
③改变的条件是。
反应Ⅰ:
反应Ⅱ:
①反应Ⅱ的活化能(正)
(逆)(填“>”“<”或“=”)。
②在T温度下,将3和7
充入2L的恒容密闭容器中发生反应Ⅰ和Ⅱ,达到平衡状态时
和
的物质的量分别为1
和0.5
。则
温度时反应Ⅰ的平衡常数
。