①
②
某实验小组控制和
初始投料比为
。在相同压强下,经过相同反应时间测得的实验数据如下(甲醇选择性指转化的
中生成甲醇的百分比):
实验编号 | T(K) | 催化剂 |
| 甲醇选择性(%) |
1 | 543 | 催化剂a | 12.3 | 42.3 |
2 | 543 | 催化剂b | 10.9 | 72.7 |
3 | 553 | 催化剂a | 15.3 | 39.1 |
4 | 553 | 催化剂b | 12.0 | 71.6 |
下列说法正确的是( )

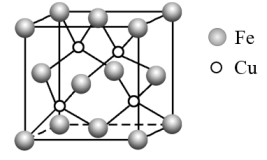
①目前测定晶体结构可靠的科学方法是。一种铜铁催化剂的晶胞如图所示,基态原子的电子排布式为,该晶胞中与一个
原子相紧邻的
原子有个。
②在光照和铜铁催化剂条件下,基态碳原子吸收能量变为激发态原子。下列3种不同状态的碳原子轨道表示式中,能量状态最高的是(填字母)。
a.
b.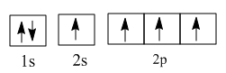
c.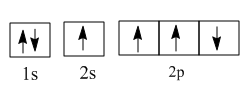

①已知Ti元素的电负性为1.5,O元素的电负性为3.5,则、O原子之间通过键形成稳定的化合物。
②电极表面生成异丙醇的电极反应式为,此电极反应需选用高活性和高选择性的电化学催化剂,其目的是。

①下列关于“球磨法”的说法正确的是。
A.铁粉碰撞活化后产生缺陷密度越大,的吸附率越高
B.可降低氢气与氮气生成氨气的焓变,使反应更易进行
C.反应在温和条件下进行,不涉及化学键的断裂与形成
②机械碰撞有助于铁粉缺陷的形成,而摩擦生热会使体系温度升高。如图是吸附量、体系温度随球磨转速变化曲线,应选择的最佳转速约转/分钟;若选择500转/分钟的转速,
的吸附量降低的原因是。

主反应:
副反应:
①
②某温度下的体积分数对
反应的影响如图所示。当
的体积分数大于
时,
的体积分数呈下降趋势,原因是。


已知:
②转化为
时,不同
条件对铬元素的去除效果如图所示,调节
时总铬浓度先减小再增大的原因是。

①标准溶液需盛放在(填“酸式”或“碱式”)滴定管中,滴定至终点的现象为。
②若未充分加热煮沸,则测量结果会(填“偏大”“偏小”或“无影响”)。
③计算样品中的质量分数:(写出计算过程)。
②可用于制备
,
浊液中加入
溶液可发生反应:
, 该反应的平衡常数
。
[已知 ,
]。

①在酸性条件下,也能氧化
, 但实际处理废水时却不在酸性条件下进行的原因是。
②当溶液初始时,总氰化物去除率下降的原因可能是。
