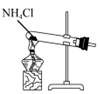
 用装置制取NH3
B .
用装置制取NH3
B .  用装置干燥NH3
C .
用装置干燥NH3
C . 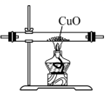 用装置还原CuO
D .
用装置还原CuO
D .  用装置处理尾气
用装置处理尾气

完成下列问题:
①向极移动(填“正”或“负”)。
②若有流过导线,则理论上可以生成标准状况下
L。
③负极的电极反应方程式为:。

已知:具有强氧化性,且氧化性随着溶液的酸性增强而增强。
和
反应的化学方程式为:
。
对氮氧化物具有强吸收效果。
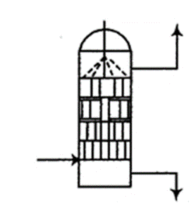
①和
反应的离子方程式为。
②吸收器内装填碎瓷片填料的目的是(填字母)。
A.增大氮氧化物的吸收速率 B.防止氮氧化物气体外逸

①当小于7时,
吸收率随
增大而减小的原因是。
②当大于7时,
吸收率随
增大而增大的原因是。