| n(SO | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |


资料:
①吸附原理
螯合树脂M中的-COOH解离出H+ , 变成-COO- , 而且树脂中含有N原子,在与Cu2+接触时,树脂中的-COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
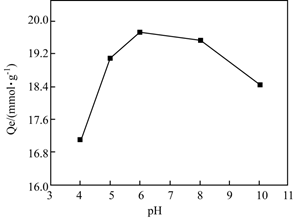
①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为时吸附效果最好。
②解释体系碱性过强时,吸附能力下降的原因。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因。

资料1:25℃时,生成氢氧化物沉淀的pH
| Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Mg(OH)2 | Ca(OH)2 | Ni(OH)2 | |
| 开始沉淀时 | 6.3 | 1.5 | 6.2 | 9.1 | 11.8 | 6.9 |
| 完全沉淀时 | 8.3 | 2.8 | 8.2 | 11.1 | 13.8 | 8.9 |
注:金属离子的起始浓度为0.1mol/L.
资料2:25℃时,Ksp(CaF2)=4×10-11 , Ksp(MgF2)=9×10-9 , ZnF2易溶于水。
资料3:P204(二乙基己基磷酸)萃取金属离子的反应为:x  +Mx+
+Mx+
 M+xH+
M+xH+

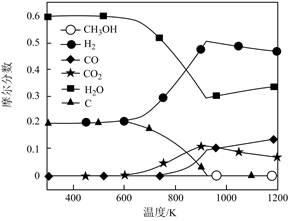
甲醇蒸汽重整制氢过程中有以下化学反应。
|
编号 |
反应 |
方程式 |
△H/kJ·mol-1 |
|
R1 |
甲醇蒸汽重整 |
CH3OH(g)+H2O(g) | △H1=+49.24 |
| R2 | 甲醇分解反应 | CH3OH(g) | △H2 |
| R3 | 水汽反应 | CO(g)+H2O(g) | △H3=-41.17 |
| R4 | 积碳反应 | CO(g)+H2(g) | △H<0 |
| CO2(g)+2H2(g) | △H<0 | ||
| 2CO(g) | △H<0 |
资料:产氢率和水碳比(S/C)的定义:
①产氢率=
②水碳比(S/C)表示反应物中H2O和CH3OH的比值,水碳比的变化是以CH3OH不变,改变H2O的物质的量加以控制。
理想产氢率=。
氨分子中具有较高的含氢量,因此是制氢的优选原料。使用NaNH2非水电解质研究液氨电解制氢原理,装置示意图如图所示。
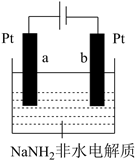
资料:2NH3 NH
+NH
①某电极上发生的电极反应为6NH3+6e-=3H2↑+6NH ,该电极为(选填a或b)极。
②写出另一极上发生的电极反应。
③不考虑其它能量损耗,利用该装置产生1mol氢气时,转移电子的物质的量是mol。
|
序号 |
操作 |
现象 |
|
实验I |
取研磨成粉状的漂白精片10g和少量氯化铜固体放入烧杯中,加足量水搅拌 |
产生黑色悬浊液,同时有大量气泡产生 |
|
理由 |
对应的离子方程式 |
|
ClO-与Cl-需在酸性条件下反应生成Cl2 |
① |
|
Ca(ClO)2溶液显碱性 |
② |
写出离子方程式:①,②。
①预测悬浊液成分为CuO,进行如图操作。
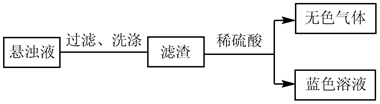
经验证无色气体为O2 , 蓝色溶液为CuSO4。此时可推断悬浊液中(选填序号)CuO。
a.一定有 b.可能有 c.一定没有
②查阅资料,悬浊液中有高铜酸钙:Ca(CuO2)2 , 实验I中主要发生了以下反应:
i。(写出该反应的离子方程式)
ii.i中生成的Ca(CuO2)2部分分解:2Ca(CuO2)2=2CaCuO2+2CuO+O2↑
FeCl2溶液 溶液C
K2FeO4溶液
写出第一步反应的离子方程式。