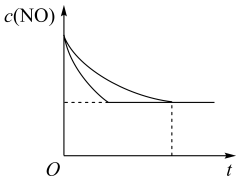
| 实验编号 | t/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| III | 350 | 1.20×10-3 | 5.80×10-3 | 82 |
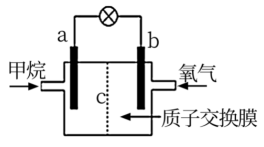
该燃料电池外电路的电流方向由到(填“a“b)。
①
②
③
则
。

①(填“>”、“<”或“=”)。
②对比a和b的正反应速率,(填“>”、“<”或“=”)。
③100℃时,该反应的化学平衡常数。
实验装置如图:

请回答下列问题: