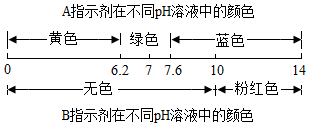
| 溶液指示剂 | 甲 | 乙 |
| A | 黄色 | 蓝色 |
| B | 无色 | 粉红色 |

如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
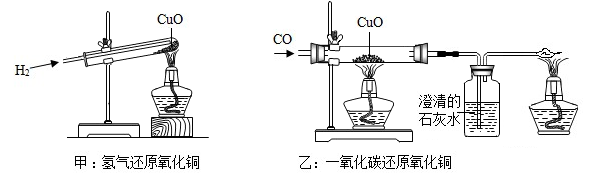
①CO能与Fe2O3反应生成Fe,CO也能与CuO反应生成Cu
②NaOH溶液能使无色酚酞试液变红色,Cu(OH)2也能使无色酚酞试液变红色
③有机化合物含碳元素,则含碳元素的化合物一定是有机化合物
④中和反应生成盐和水,则生成盐和水的反应一定是中和反应
⑤碱溶液能使无色酚酞变红,能使无色酚酞变红的溶液一定是碱溶液
|
实验方案 |
实验步骤 |
实验现象 |
实验结论 |
|
方案一 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
稀硫酸过量 |
|
方案二 |
取样,滴入几滴紫色石蕊试液 |
溶液变红 |
稀硫酸过量 |
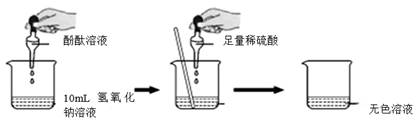
上述设计的实验方案中,正确的是(填“方案一”或“方案二”)。请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是,实验现象及对应结论是。
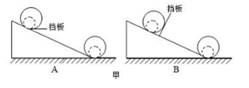
图甲是用挡板控制大小不同的两个小球在斜面上起始位置的两种方案,小柯实验时选择 A 方案而不能选择 B方案的原因是。
小柯选择大钢球、小钢球、木球以及可调整倾角的斜面进行实验。分别让球从斜面同一高度由静止开始释放,利用测速仪测出球到达水平位置时的速度如表所示。
| 斜面倾角 速度(m/s) 球的类别 | 10° | 20° | 30° | 40° | 50° | 60° |
| 大钢球 | 2.67 | 2.67 | 2.67 | 2.75 | 2.88 | 2.97 |
| 小钢球 | 2.67 | 2.67 | 2.67 | 2.75 | 2.88 | 2.97 |
| 木球 | 2.67 | 2.67 | 2.67 | 2.67 | 2.74 | 2.89 |
分析表中数据可知:要使球到达水平位置时的速度与球是钢质或木质无关,则斜面倾角不可能是。
A.15° B.25° C.35° D.45°
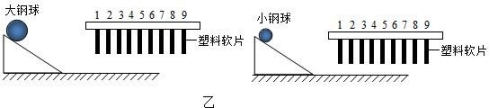
小柯利用图乙装置做“探究动能大小与质量关系”的实验时,通过观察球撞击相同塑料软片的数目来比较球的动能大小(图中未画出固定塑料软片的装置)。老师指出此装置不适合体积不同的两个球做实验,原因是塑料片对不同体积的小球的不同。
步骤1:向三支试管中分别滴加酚酞后,Na2CO3溶液中显红色,说明Na2CO3溶液显性;
步骤2:小柯把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;
步骤3:把烧杯中的混合物进行过滤,得到滤液,滤液中一定不含。
(选填答案:A、稀盐酸 B、澄清石灰水 C、碳酸钠溶液)
【实验猜想】步骤3所得滤液中溶质可能为:
①NaCl Na2CO3; ②NaCl CaCl2和NaOH; ③NaCl Na2CO3和NaOH; ④…
【实验验证】(提示:CaCl2溶液显中性)
|
实验操作 |
实验现象 |
实验结论 |
|
取少量滤液于试管中,加入足量CaCl2溶液 |
|
猜想③成立 |
【反思评价】有同学提出CaCl2溶液改为稀盐酸,若观察到有气泡产生且红色消失,则证明猜想③成立。小柯同学认为不正确,其理由是:。

| 反应前 | 完全反应后 | |
| A组 | 玻璃管和固体物质的质量共42.5克 | 玻璃管和固体物质的质量共40.9克 |
| B组 | U形管和其中物质的质量共180.0克 | U形管和其中物质的质量共182.3克 |
请回答下列问题:
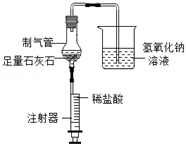
的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:

| 实验编号 | ① | ② | ③ | ④ |
| NaOH溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
| Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
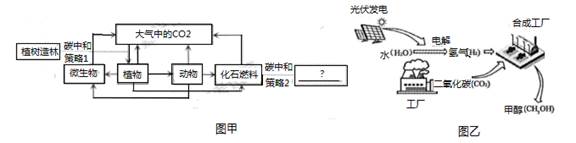
可采取的碳中和策略②有。
①浙江大学研发的“二氧化碳烟气微藻减排技术”,利用微型藻类吸收二氧化碳实现固碳,该技术的本质是利用微藻的光合作用实现固碳。
②固碳的另一种方法是将空气通入氢氧化钾溶液反应生成碳酸钾和水。写出用氢氧化钾捕获CO2的化学方程式。
③我国研发的“液态太阳燃料合成技术”(乙),甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。 甲醇制取过程中能量转化是太阳能→电能→能。甲醇合成时,若碳元素全部来自于二氧化碳,则制取20吨甲醇需要消耗二氧化碳吨。 (二氧化碳转化成甲醇的方程式为:CO2+3H2 CH3OH+H2O)

①与燃油汽车相比,纯电动汽车每行驶100km会向空气减少排放kg的二氧化碳。
(ρ汽油=0.7×103kg/m3 , 结果精确到0.1)
②从获取电能的各种方式看,相对于燃煤发电,符合“减碳”理念的是发电。