 B .
B .  C .
C .  D .
D . 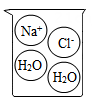
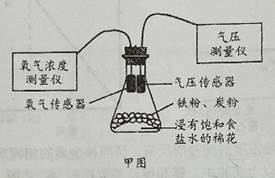
①连接实验仪器并进行气密性检查;
②称取一定量铁粉和2.0克活性炭,在研钵内混合均匀待用,将浸有饱和食盐水的棉花平铺在锥形瓶底部;
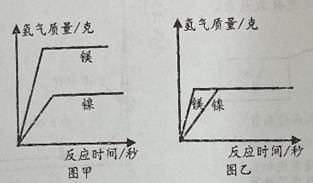
③用纸槽将取出的铁粉和活性炭粉快速均匀平铺在棉花上,迅速把带有氧气传感器的单孔橡皮塞旋紧,如图甲所示;
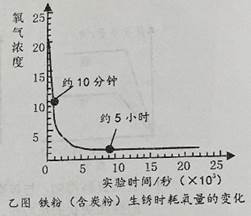
④多次测量,绘制氧气浓度的变化曲线,如图乙所示,得到气压测量仪器上的数据,发现气压先上升后下降,手触摸锥形瓶外壁,有明显的发热现象;
⑤将铁粉换成是等量的粗铁丝,重复上述实验,刚开始无明显现象,几天后粗铁丝表面红色物质明显增多,氧气浓度不断下降。
【查阅资料】采用活性炭可使铁粉疏松、透气;饱和食盐水可促进耗氧反应。
结合上述过程,完成下列问题:
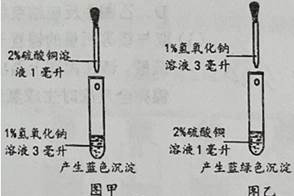
查阅资料发现:
①在碱性条件下,硫酸铜溶液和氢氧化钠溶液反应生成氢氧化铜;
②在酸性条件下,硫酸铜溶液和氢氧化钠溶液反应生成碱式硫酸铜【Cu4(OH)6SO4】;
③碱式硫酸铜为蓝绿色固体,不溶于水但溶于酸,与盐酸反应的化学方程式为:Cu4(OH)6SO4+6HCl = CuSO4 + 3CuCl2 + 6H2O;
|
步骤 |
主要实验操作 |
实验现象 |
|
① |
取乙组实验后的混合物过滤 |
得到蓝绿色沉淀 |
|
② |
取蓝绿色沉淀,用蒸馏水洗涤几次 |
无明显现象 |
|
③ |
向最后一次洗涤液中滴加氯化钡溶液 |
|
|
④ |
取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 |
沉淀全部溶解,得到蓝绿色溶液 |
|
⑤ |
取少量蓝绿色溶液于试管中,滴加氯化钡溶液 |
产生白色沉淀 |
|
实验结论:蓝绿色沉淀是碱式硫酸铜 |
||
完成步骤③实验现象。
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
| 装置丁的总质量/g | 100.50 | 101.08 | 101.66 | 101.68 |