
【设计实验】小组同学经过认真分析思考,提出了自己的假设,并设计了图甲所示的实验A和B进行操究。实验时,观察到试管A中有气泡,试管B中没有气泡,从而验证了自己的假设是成立的。
【迁移应用】一次课外实验的意外现象:镁条放入Na2CO3溶液中,快速产生气泡。 请结合设置对照实验的思想,完成“气体是由什么反应生成的”问题探究。
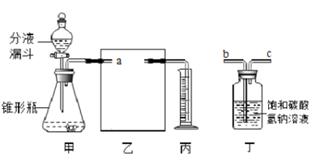
【实验探究】查阅资料:①镁能与水缓慢反应生成氢气;②Na2CO3溶液呈碱性,其溶液中除了 Na+、 CO32-、水分子外,还有OH-。
小组同学设计了如图丙对照试验E、F和G。
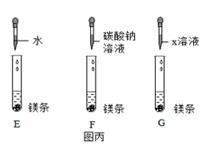
往镁条中分别加入等量的水、Na2CO3溶液、x溶液进行实验。一段时间后,观察到试管E、G中有气体产生,但缓慢且少,试管F中产生气体既快又多。从对照实验设置的角度分折,实验G所加“x溶液”应该是;
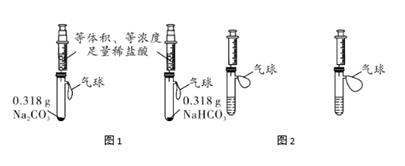
【提出问题】碳酸钠、碳酸氢钠和稀盐酸反应?
【设计与实验】甲设计的实验如图1所示实验时,将两注射器中的稀盐酸同时全部注入试管中,观察到图2所示现象。
⑴乙对甲的实验提出了质疑,他认为:
①碳酸钠、碳酸氢钠固体和稀盐酸反应都很剧烈,通过肉眼观察很难判断;
②图2中两气球大小不一样是因为: ,所以实验中不应该取相同质量的碳酸钠和碳酸氢钠,而应取含碳元素质量相同的碳酸钠和碳酸氢钠。
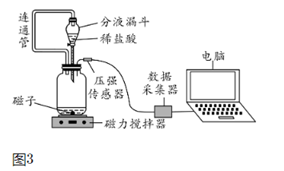

⑵小组同学在老师指导下设计了图3所示的实验。
①连通管的作用。
②广口瓶内压强随时间变化如图4所示。
【实验结论】分析图4所示的实验数据可得到实验结论。
⑶通过实验过程和数据分析,将【提出问题】补充完整。
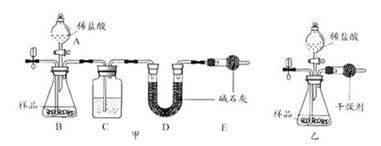
|
选项 |
实验装置 |
反应开始前鼓入的气体 |
反应结束后鼓入的气体 |
|
A |
甲 |
氮气 |
氮气 |
|
B |
甲 |
干燥空气 |
干燥空气 |
|
C |
乙 |
氮气 |
氮气 |
|
D |
乙 |
干燥空气 |
干燥空气 |
①取50克样品加入足量的蒸馏水,充分搅拌静置后,将浸出液全部转移到烧杯中;
②在烧杯中加入足量的CaCl2溶液,得到沉淀;
③将沉淀过滤、洗涤、烘干后得到5克固体。
求样品中碳酸钾的质量分数。(杂质不发生反应,K2CO3+CaCl2=2KCl+CaCO3↓)
|
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
|
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
|
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
(写出计算过程,已知Na2CO3+2HCl=2NaCl+H2O+CO2↑)