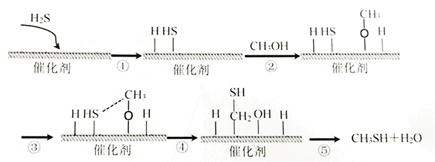
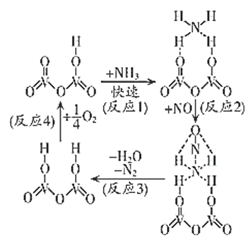
CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )

| A | B | C | D | |
| 实验 | | | | |
| 现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
| 结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeCl3溶液中通入足量的H2S | 生成两种沉淀 | Fe3+的氧化性强于S |
| B | 向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液 | 先出现浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| C | 向FeCl3溶液中滴入几滴30%的H2O2溶液 | 有气体产生,一段时间后,FeCl3溶液颜色加深 | Fe3+能催化H2O2 分解,且该分解反应为放热反应 |
| D | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
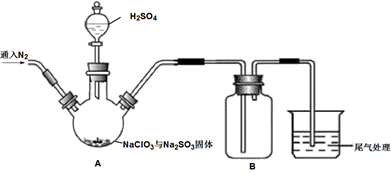
实验Ⅰ:制取并收集ClO2 , 装置如图所示:
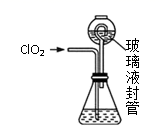
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L−1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I−+S4O62-)。
装置中玻璃液封管的作用是。
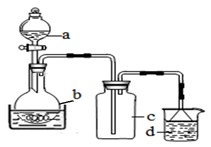
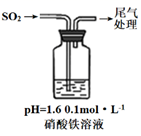
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、、,用浓硝酸洗涤、干燥。
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是。
②用5mL 溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
i.缓慢通入SO2 , 溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2 , 溶液逐渐变为深棕色。
已知:Fe2++NO⇌[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:。
⑤步骤ii后期反应的离子方程式是。
Ⅰ.称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2 , 冷却后过滤,滤液定容于250 mL容量瓶中;
Ⅱ.取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色;
Ⅲ.向Ⅱ的锥形瓶中加入c mol·L−1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
Ⅳ.平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。
已知:ⅰ.F−与Fe3+生成稳定的FeF63−(无色)。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2+I− ⇌ I3−(棕黄色)。
ⅳ.I2+2Na2S2O3= 2NaI+Na2S4O6(无色)。
①加入NH4F溶液的目的是。
②Cu2+和I−反应的离子方程式是。
③加入过量KI溶液的作用是。

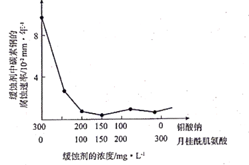
已知:Ⅰ.ZnSO3· H2O微溶于水,ZnSO4易溶于水。
Ⅱ.25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。

Ⅲ.O3为强氧化剂,1 mol O3被还原转移2 mol e− , 同时生成1 mol O2。

①pH=3.5的溶液中含S(+4价)的离子主要是。
②一段时间后,溶液的pH减小,此过程中主要反应的离子方程式是。
③解释O3氧化可防止管道堵塞的原因:。
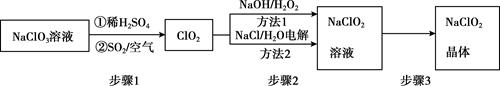
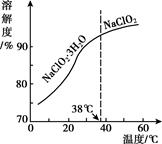
已知:①纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol•L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O32-=2I-+S4O62-)。样品中NaClO2的质量分数为。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是(用离子方程式和文字表示)。
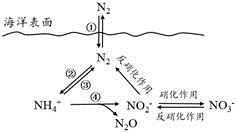
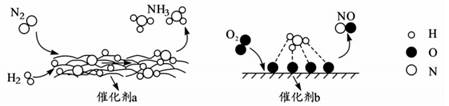
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
NH4++ 5O2=2NO2-+ H+++
|
温度/℃ |
样本氨氮含量/mg |
处理24 h |
处理48 h |
|
氨氮含量/mg |
氨氮含量/mg |
||
|
20 |
1008 |
838 |
788 |
|
25 |
1008 |
757 |
468 |
|
30 |
1008 |
798 |
600 |
|
40 |
1008 |
977 |
910 |
硝化细菌去除氨氮的最佳反应温度是,在最佳反应温度时,48 h内去除氨氮反应的平均速率是mg·L-1·h-1。

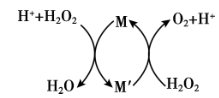
① 结合电极反应式简述间接氧化法去除氨氮的原理:。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将(填“增大”、“不变”或“减小”),请简述理由:。