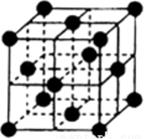

已知:X、Y是生活中常见的金属单质,A、B都是氧化物且A是红棕色粉末。
回答下列问题:
①若试剂1和试剂2的酸碱性相同,则C溶液显(填“酸性”、“碱性”或“中性”);
②若试剂1和试剂2的酸碱性不同,试剂1和B的离子方程式是。
①Y单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式。如果稀硝酸过量,则会有Fe3+生成,可以选择试剂 进行验证。
②D的阳离子检验可以用试剂 检验。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是含极性键和非极性键的非极性分子
④B2A2中心原子的杂化类型为sp杂化
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键