
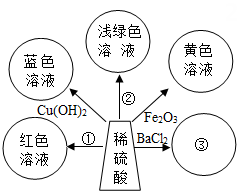
①图甲,在一定量Fe(NO3)2、AgNO3和Cu(NO3)2的混合溶液中加入铁粉
②图乙,向等质量的锌粉和铁粉中,分别加入足量且相同质量分数的稀盐酸
③图丙,在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
④图丁,向质量和质量分数都相等的稀盐酸中分别加入足量的锌粉和铁粉

 B .
B .  C .
C .  D .
D . 
 B . 稀释浓硫酸
B . 稀释浓硫酸  C . 使用测电笔
C . 使用测电笔  D . 滴加溶液
D . 滴加溶液 

根据上述的操作和相关现象分析,下列描述错误的是( )
 B . 加热煎制
B . 加热煎制  C . 取液弃渣
C . 取液弃渣  D . 装袋保存
D . 装袋保存 

| 选项 | 操作 | 现象 | 结论 |
| A | 向某无色溶液中滴加酚酞试液 | 溶液变红 | 该溶液为碱溶液 |
| B | 向某白色粉末中滴加稀盐酸 | 有气泡产生 | 该溶液中一定含有CO32- |
| C | 在久置烧碱样品中滴加少量稀盐酸 | 无明显现象 | 样品没有变质 |
| D | 将铁片插入硫酸铜溶液 | 铁片表面有红色固体析出 | Fe的活动性强于Cu |
| 选项 | 性质 | 用途 |
| A | 白色硫酸铜粉末遇水会变蓝色 | 检验水的存在 |
| B | 浓硫酸具有脱水性 | 干燥氧气 |
| C | 稀盐酸能与某些金属反应 | 除铁锈 |
| D | 氢氢化钠固体能潮解 | 干燥二氧化碳 |
 B . 浓硫酸的稀释
B . 浓硫酸的稀释  C . 称取一定质量的NaOH固体
C . 称取一定质量的NaOH固体  D . 收集CO2
D . 收集CO2 
| 选项 | 禁忌 | 原理解释 |
| A | 用锡壶装醋酸 | 活动性顺序:Sn<H |
| B | 煤气泄漏时,开灯检查 | 电火花会点燃混合气体,气体爆炸 |
| C | 用稀HCl除铁锈时,浸泡太久 | 6HCl+2Fe=2FeCl3+3H2↑ |
| D | 浓硫酸洒在手上,直接用水冲洗 | 浓硫酸具有吸水性 |



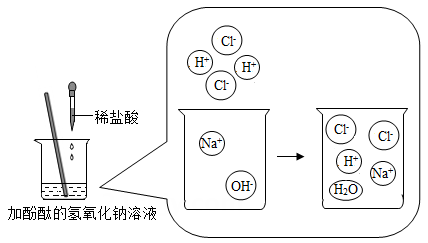
回答下列问题:

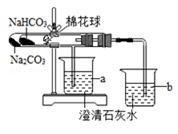
①加热一段时间后,a、b两烧杯分别看到的现象是;
由此可得出的结论是;
②碳酸氢钠分解的化学反应方程式:;
③该装置设计的优点是;
④实验中应注意的问题是。
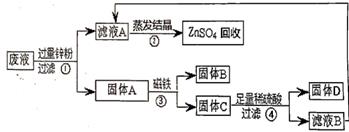


试分析计算回答:


小明同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2 ↑中NaHCO3与CO2之间量的关系。

|
反应前 |
反应后 |
|
|
NaHCO3/g |
锥形瓶+稀硫酸/g |
锥形瓶+反应后溶液/g |
|
1.26 |
24.59 |
25.36 |
|
实验编号 |
氯化镁溶液浓度/g•L﹣1 |
反应温度/℃ |
Mg(OH)2转化率/% |
|
a |
20 |
30 |
27.06 |
|
b |
40 |
30 |
56.77 |
|
c |
40 |
40 |
69.64 |
|
d |
40 |
60 |
54.30 |
|
e |
60 |
60 |
50.60 |

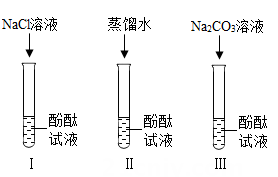
小明同学在和老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞试液变红也是由于溶液中存在OH-。”你认为Na2CO3溶液中存在OH-的原因是。
[实验一]小乐分别取CO2与NaOH反应后的溶波少许于2支试管中,按如下方案进行,
|
方案 |
实验操作 |
实验现象 |
实验结论 |
|
1 |
滴加适量溶液 |
有白色沉淀生成 |
CO2与NaOH溶液发生了化学反应 |
|
2 |
滴加足量的稀盐酸 |
|
[实验二]用如图甲所示装置将反应产生的CO2持续通入NaOH溶液中,用pH传感器测定反应过程中溶液的pH,结果如图乙所示。(Na2CO3、NaHCO3溶液的pH分别约为11.0和8.5)

⑴图甲所示实验中,用Na2CO3和稀H2SO4反应来制取CO2 , 而不用大理石和盐酸反应来制取,理由是。
出的HCl气体会影响pH的测定
⑵根据图乙所示曲线,写出AB段发生的化学反应。

设计思路:用空气将装置B中生成的二氧化碳缓缓吹入装置D中,利用装置D的质量变化测定食用碱中Na2CO3的含量。请结合实验装置和设计思路,回答下面问题: