日用品 | A.洁厕灵 | B.洗涤灵 | C.洗发水 | D.消毒液 |
pH | 1 | 7 | 9 | 12 |
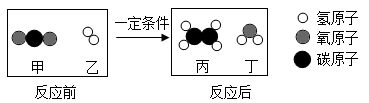
某北方地区用萝卜叶酱菜制作流程如下:
原料→挑选→切碎→清洗→沥水→腌渍Ⅰ→腌渍Ⅱ→脱盐→酱制→调味→真空包装→杀菌→冷却→成品。
萝卜叶的腌制过程属微生物的发酵过程,蛋白质在微生物蛋白酶和肽酶作用下,会产生一些氨基酸、肽类等风味物质。腌制过程由于微生物的生长代谢消耗了萝卜叶的蛋白质,从而使蛋白质含量下降。酱制、调味后的样品中蛋白质含量增高,其蛋白含量主要来源于酱制和调味过程加入的酱油及味精。酱油中含有蛋白质,味精属谷氨酸钠盐,使成品萝卜叶酱菜中的蛋白质增高。
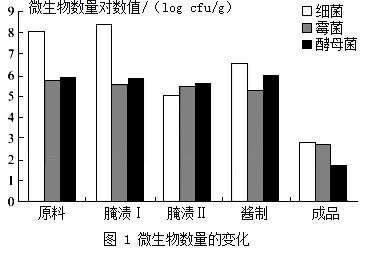
选取原料、腌渍Ⅰ、腌渍Ⅱ、酱制和成品五个工序的样品,进行细菌、霉菌和酵母菌的测定,其实验结果如图1所示。腌渍Ⅰ阶段主要以乳酸菌发酵为主导,乳酸菌正处于对数期,迅速增长;腌渍Ⅱ阶段主要是腌制过程中的盐分产生的高渗透压及发酵所产生乳酸等物质抑制部分微生物的生长。
酱菜中含有乳酸菌,能够调节肠胃功能,有助于儿童、中老年人消化。另外,酱腌中蛋白质、维生素C含量普遍较高,其中含有的乳酸钙还能促进儿童的成长发育。一些蔬菜本来含钙、铁的量较高,经过腌制后得到浓缩,钙、铁含量更为丰富。因此,适量食用酱菜对人体健康有益。
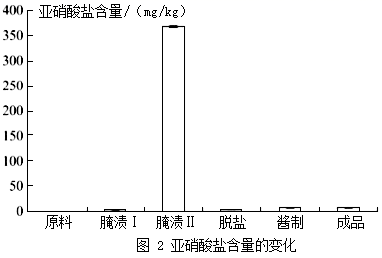
但是,酱菜制作过程中也会产生较高的亚硝酸盐。亚硝酸盐与胃酸反应,产生亚硝酸(HNO2)和氯化物。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。酱菜制作过程中亚硝酸盐含量变化如图2所示。
依据文章内容回答下列问题。
A 萝卜叶的发酵过程属于物理变化
B 酱菜制作过程中,亚硝酸盐含量在发酵后期达到一个峰值后又迅速下降
C 酱菜制作过程中,霉菌和酵母菌的数量整体呈下降的趋势,细菌数量整体呈上升趋势
D 霉菌和酵母菌在整个腌制、酱制过程中波动较小
(查阅资料)
①84消毒液为无色或淡黄色液体,是次氯酸钠(化学式NaClO)和表面活性剂的混合物。
②消毒杀菌就是使细菌病毒的蛋白质变性;鸡蛋清中蛋白质变性会变白。
(进行实验)
实验1:探究84消毒液漂白性
室温下,取不同浓度的消毒液各30mL于4只烧杯中。将形状大小相同的布条投入烧杯中,记录如下:
|
实验编号 |
布条种类 |
84消毒液体积与水的体积比 |
实验现象 |
|
1-1 |
粉红色棉质 |
1:0 |
布条立即褪色,而且完全退成白色 |
|
1-2 |
粉红色棉质 |
1:25 |
刚接触溶液,布条褪色缓慢。1分钟后布条颜色退尽,呈淡粉色。15分钟后,布条的淡粉色完全退尽。 |
|
1-3 |
粉红色棉质 |
1:100 |
刚接触溶液,布条退色不明显。2分钟后,布条颜色基本退尽,呈粉色。20分钟后,布条粉色完全退尽。 |
|
1-4 |
粉红色棉质 |
1:200 |
刚接触溶液,布条不退色。5分钟后,布条退成淡粉色。25分钟后布条仍呈淡粉色。 |
1小时后,发现实验1-1中的布条已经浸烂,实验1-2中布条抽出的棉线极易被拉断,实验1-3、实验1-4中布条损害很小。
实验2:探究84消毒液消毒杀菌效果。
室温下,分别取2mL鸡蛋清于四支试管中,试管编号分别为2-1、2-2、2-3、2-4,分别向四支试管中滴加10滴消毒液原液、1:25、1:100、1:200的溶液,振荡静置15分钟后观察现象。记录如下:
|
实验 编号 |
第一步 |
84消毒液体积与水的体积比 |
实验现象 |
|
2-1 |
鸡蛋清2mL |
1:0 |
液体表面产生大量气泡,无其他现象 |
|
2-2 |
鸡蛋清2mL |
1:25 |
液体中产生大量白色物质 |
|
2-3 |
鸡蛋清2mL |
1:100 |
液体中产生少量白色物质 |
|
2-4 |
鸡蛋清2mL |
1:200 |
液体中产生极少量白色物质 |
84消毒液主要成分为次氯酸钠(化学式NaClO),其中氯元素的化合价为。
洁厕灵主要成分是盐酸,84消毒液与洁厕灵混用,会发生反应产生有毒的氯气,同时生成两种生活中常见的化合物,请补全发生反应的化学方程式:2HCl+NaClO═Cl2↑++