| 物质(括号内为杂质) | 除杂试剂 | |
| A | FeCl2溶液(FeCl3) | Fe粉 |
| B | NaCl溶液(MgCl2) | NaOH溶液、稀HCl |
| C | Cl2(HCl) | H2O、浓H2SO4 |
| D | NO(NO2) | H2O、无水CaCl2 |

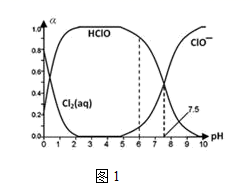
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为。

①从能量角度看,C、D、E中最不稳定的离子是(填离子符号)。
②B→A+D反应的热化学方程式为(用离子符号表示)。

已知:几种盐的溶解度
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
|
|
溶解度(20℃,100gH2O时) |
36.0 |
21.7 |
9.6 |
37.2 |
②从平衡移动角度解释该反应发生的原因。
③操作①的名称是。
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量