
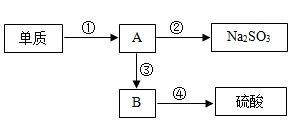
①SO2可使澄清石灰水变浑浊;
②SO2可使品红溶液的红色褪去,而CO2不能;
③SO2可与酸性的KMnO4溶液反应使其褪色,而CO2不能;
④CuSO4为白色粉末,遇水可生成胆矾.
⑤浓硫酸与焦炭在加热的条件下发生如下反应:C+2H2SO4(浓) △= CO2↑+2SO2↑+2H2O
在对该反应的产物的探究中需用下列A、B、C装置:

请根据提供的信息回答下列问题:
【进行猜想】

猜想Ⅰ:该溶液的溶质是NaCl;猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;猜想 IV:该溶液的溶质是NaHCO3。
|
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
|
常温下的溶解度/g |
36 |
109 |
21.5 |
9.6 |
|
常温下稀溶液的pH |
7 |
13 |
11 |
9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3 , 因为常温下NaHCO3溶液溶质的质量分数最大是(精确到0.1%)。

①产生白色沉淀的化学方程式是。
②实验可以判断原无色溶液中含有的溶质有。
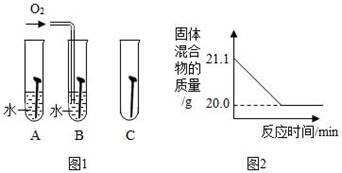
①下列不属于铁合金的是(选填字母)。
A.Fe(OH)3 B. 生铁 C. 不锈钢
②图1是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是(选填字母)。
在Fe2O3中,氧元素的质量分数为 。
①由图可知:生成CO2气体的质量为 g。
②计算反应后固体混合物中FeO的质量分数 (请根据化学方程式写出完整的计算步骤)

CO2质量=10克−5.4克=4.6克
设碳酸钙质量为M
|
CaCO3 |
|
CO2↑+CaO |
|
100 |
44 |
|
|
M |
4.6克 |
所以M=10.5克
CaCO3%=10.5克10克×100%=105%
小科的计算结果与事实不符,产生错误的原因是:.
|
第一次 |
第二次 |
第三次 |
|
|
加入稀盐酸的体积(毫升) |
10 |
10 |
10 |
|
进入量筒内水的体积(毫升) |
220 |
220 |
110 |