 C .
C .  D .
D . 
| 选项 | 实验目的 | 实验设计 |
| A | 区分食醋和食盐水 | 闻气味 |
| B | 从Fe、Cu的混合粉末中分离出Fe粉 | 用磁铁吸引 |
| C | 鉴别白色粉末硫酸铜和硫酸钠 | 用水溶解后观察颜色 |
| D | 除去CO2中混有的少量CO | 点燃混合气体 |


(设计实验)
|
实验步骤 |
实验现象 |
实验结论 |
|
⑴取一定量白色粉末于烧杯中,加足量水,搅拌 |
|
猜想三不成立 |
|
⑵取少量(1)中所得溶液于试管中,向其中滴入氯化铜溶液 |
|
猜想二不成立 |
|
⑶另取少量(1)中所得溶液于试管中,向其中滴加过量的溶液 |
产生白色沉淀 |
猜想一成立 |
写出步骤(3)中发生反应的化学方程式。

①将小烧杯中的所有稀盐酸分几次加入到大烧杯中并不断搅拌,判断白色粉末中碳酸钙完全反应的实验现象是。
②已知反应前的总质量[m(大烧杯+白色粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是(填序号)。
A.m(小烧杯)
B.m(大烧杯)
C.m(大烧杯+反应后剩余物)
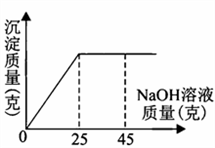
请你仔细分析此关系图,并进行计算。