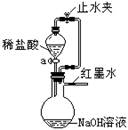
物质王国发生了一起团伙盗窃案,“警察”把三名“嫌疑犯”(分别是稀硫酸、氯化钠溶液和石灰水,见图)带回了“警察局”。上级派出下列四名“警察”分别去审问“他们”(即把“他们”鉴别出来)。无法完成任务的“警察”是( )

 B . 稀盐酸警察
B . 稀盐酸警察 C . 无色酚酞试液警察
C . 无色酚酞试液警察 D . 纯碱溶液警察
D . 纯碱溶液警察
步骤1:分别在研钵中将上述物质倒烂,加乙醇溶液(乙醇和水的体积比为1:1浸泡10分钟.
步骤3:将步骤2中得到的浸取液,分别滴入到澄清石灰水中.
植物 | 植物 | 浸取液 | 在不同溶液中所呈现的颜色 | |
名称 | 颜色 | 颜色 | 澄清石灰水 | 食醋 |
牵牛花 月季花 萝卜花 丝瓜花 | 蓝紫 大红 紫 黄绿 | 红棕色 玫瑰红 紫红 黄绿 | 黄绿 橙黄 黄绿 黄 | 粉红 粉红 粉红 黄 |
A.氢氧化钠溶液 B.稀硫酸 C.氨水 D.食盐水
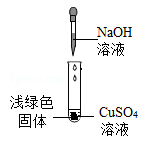
【查阅资料】
①NaOH与CuSO4反应会生成Cu(OH)2 , 也会生成Cu4(OH)6SO4(碱式硫酸铜)。
②Cu(OH)2在80℃会分解生成CuO
③Cu4(OH)6SO4不溶于水,能与酸反应,分解温度需300℃
【猜想与假设】
猜想一:浅绿色固体为Cu(OH)2;
猜想二:浅绿色固体为Cu4(OH)6SO4
猜想三:浅绿色固体为Cu(OH)2和Cu4(OH)6SO4
【获取事实与证据】
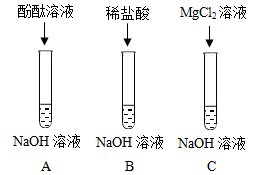
【资料】氯化镁溶液不能使酚酞溶液变红。
①加入Na2CO3溶液,如果不产生气泡,能证明反应发生
②加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生
③加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生
【提出问题】上层清液中溶质的成分是什么呢?(指示剂除外)
【作出猜想】经过讨论,大家作出两种合理的猜想:
①NaCl②NaCl和MgCl2。
【实验验证】将猜想②补充完整并设计实验加以验证。
|
实验操作 |
实验现象 |
结论 |
|
取少量上层清液于试管中, 滴加 |
|
猜想②正确 |
|
实验一 |
实验二 |
实验三 |
实验四 |
|
|
食用碱的质量 |
10g |
10g |
10g |
10g |
|
加入CaCl2溶液的质量 |
20g |
40g |
60g |
80g |
|
生成沉淀的质量 |
3g |
m |
8g |
8g |
请分析表中数据回答并计算:

求:
A.该纯碱样品中NaCl的质量分数;
B.反应所用稀盐酸的溶质质量分数;
C.反应后所得溶液中NaCl的质量分数;
D.反应生成水的质量。
①取 10 克样品于烧杯中,加入蒸馏水充分溶解,配制成 60 克溶液;
②在配制的溶液中,加入一定量的硝酸银溶液,恰好完全反应;
③将上述混合液过滤,沉淀经洗涤、干燥后,称得质量为 14.35 克。 请根据上述实验回答:(相关反应的化学方程式为:KCl+AgNO3=AgCl↓+KNO3)
A.晶体没有干燥
B.蒸发时液体飞溅
C.硝酸钾残留在玻璃棒上