植物 | 花生 | 苹果 | 西瓜 | 沙枣 |
适宜的pH范围 | 5.0~6.0 | 5.0~6.5 | 6.0~7.0 | 8.0~8.7 |
|
阴离子 阳离子 |
OH﹣ |
NO3﹣ |
Cl﹣ |
SO42﹣ |
CO32﹣ |
|
K+ |
乙 |
丁 |
戊 |
||
|
Ba2+ |
甲 |
丙 |
探究活动一:认识工具
如上图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
已知某氯化钠样品中,含有不溶性杂质(泥沙)和可溶性杂质(氯化镁、氯化钙)。为了得到纯净的氯化钠,某实验小组设计了下列实验方案,请你完成相关问题:
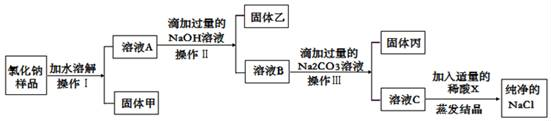
在上述实验方案中,操作Ⅰ、操作Ⅱ、操作Ⅲ都是将固体和溶液分离,该操作是实验基本操作中的。