
图1所示为氢燃料电池的工作原理:将氢气送到燃料电池中,经过催化剂的作用,通过质子交换膜,再与氧气反应,同时产生电流。请写出氢燃料电池中发生反应的化学方程式:。
铁酸锌(ZnFe2O4)可用于循环分解水制取氢气,其中涉及的反应有:
①6ZnFe2O4 6ZnO+ 4Fe3O4+O2↑;
②3ZnO+2Fe3O4+H2O 3ZnFe2O4+H2↑
ZnFe2O4中Fe的化合价为。
在常温和250 kPa下,镧镍合金(LaNi5)吸收氢气生成 LaNi5H7 , 该物质能在一定条件下分解释放出氢气,该储氢原理属于变化。
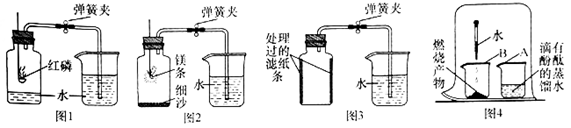
写出红磷在空气中燃烧的化学方程式:。
①用弹簧夹夹紧胶皮管;
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
③;
④观察并记录水面的变化情况。
多次实验发现,集气瓶内水平面上升始终小于1/5。
某同学进行图2所示实验时发现,产物中有少许黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与空气中的反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气。
(实验过程)进行图4所示实验:取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
(实验结论)观察到的现象是,据此可推断燃烧产物中含氮化镁(Mg3N2)。
某同学利用铁生锈的原理,用铁粉测定空气中氧气的含量,实验装置如图3所示。当烧杯中不再有水进入集气瓶时,该同学停止实验。实验开始和结束时所采集的数据如下表:
|
实验前的体积 |
实验后的体积 |
|
|
集气瓶内空气 |
烧杯内水 |
烧杯内剩余水 |
|
250mL |
180.0mL |
129.5mL |
①铁生锈的原理是铁与空气中的发生反应。
②实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再将滤纸条贴在集气瓶内壁,其目的是。
③该同学所测得的空气中氧气的体积分数为(精确到0.1%)。
④与红磷燃烧法相比,用该法测定空气中氧气含量的主要优点是。
取2.4g镁条在足量O2和N2的混合气体中完全燃烧,所得固体质量为a g,则a的取值范围是3.3<a<。
步骤1 取样品10g于烧杯中,用蒸馏水溶解,得到50mL溶液;
步骤2 加入新制的蓝色氢氧化铜浊液;
步骤3
加热(反应原理:C6H12O6+2Cu(OH)2 C6H12O7+Cu2O↓+2H2O);
步骤4 称量生成的砖红色氧化亚铜(Cu2O)沉淀的质量,称得其质量为7.2g。
计算该样品中葡萄糖的质量分数。(请将解题过程写到答题纸上)