①取该样品溶于水,得到无色溶液;
②取适量上述溶液加过量的 BaCl2 溶液,出现白色沉淀,过滤;
③向步骤②所得沉淀中加入过量的稀 HNO3 , 沉淀部分消失并产生气泡;
④取步骤②的溶液加入 AgNO3 溶液生成白色沉淀,再加入稀 HNO3 , 振荡,沉淀不消失。
下列分析正确的是( )
 B .
B . 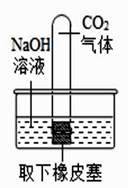 C .
C . 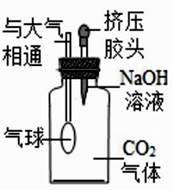 D .
D . 
实验操作 | 甲 | 乙 | 丙 | 丁 |
加入无色酚酞试液 | 不变色 | 变红 | 不变色 | 不变色 |
加入硝酸钡溶液 | 白色沉淀 | 无明显现象 | 白色沉淀 | 无明显现象 |
加入锌粒 | 无明显现象 | 无明显现象 | 产生无色气体 | 产生无色气体 |
则对应甲、乙、丙、丁顺序的四种物质是( )
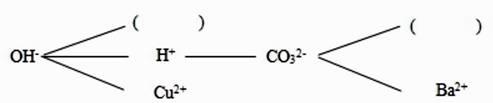
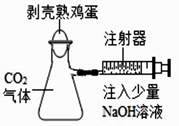
⑴取少量吸收 SO2 一段时间后的 NaOH 样品,用适量蒸馏水完全溶解。
⑵用试管取少量该样品溶液。
⑶往试管中逐滴加入时,停止加入。
⑷后续实验的操作是,则 NaOH 已完全反应。
【提出问题】CO2 与 NaOH 溶液反应后的溶质组成
【查阅资料】①NaHCO3+NaOH═Na2CO3+H2O
②盐酸滴入碳酸钠溶液中,实际反应分两步进行
第一步反应:NaCO3+HCl=NaCl+NaHCO3
第二步反应:NaHCO3+HCl=NaCl+H2O+CO2↑
猜想 2:溶质为(填化学式,以下同);
猜想 3:溶质为;
猜想 4:溶质为;
①向所得溶液中加入足量的 CaCl2 溶液,若有白色沉淀生成,过滤后向溶液中加入足量的稀盐酸无气泡产生,则溶质为。
②向所得溶液中加入足量的 CaCl2 溶液,若无白色沉淀生成,溶液中加入足量的稀盐酸有气泡产生,则溶质为。
③向所得溶液中加入足量的 CaCl2 溶液,若有白色沉淀生成,过滤后向溶液中加入足量的稀盐酸有气泡产生,则溶质为。

不同 pH 条件下,处理 5 天后,灰藓体内叶绿素含量(mg/g 鲜重):
处理 | pH=7.0 | pH=5.5 | pH=4.0 | pH=3.0 | pH=2.5 |
叶绿素含量 | 0.861 | 0.875 | 0.824 | 0.750 | 0.661 |
请你回答:
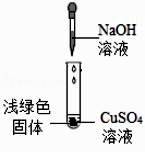
【查阅资料】
① NaOH 与 CuSO4 反 应 会 生 成 Cu(OH)2 , 也 会 生 成Cu4(OH)6SO4(碱式硫酸铜)。
②Cu(OH)2 在 80℃会分解生成 CuO。
③Cu4(OH)6SO4 不溶于水,能与酸反应,分解温度需 300℃。
【猜想与假设】
猜想一:浅绿色固体为 Cu(OH)2。
猜想二:浅绿色固体为。
猜想三:浅绿色固体为 Cu(OH)2 和 Cu4(OH)6SO4。
【获取事实与证据】
①取少量浅绿色固体放入试管中,加热至 100℃,观察到黑色固体物质,说明浅绿色固体中存在。
②另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加 Ba(NO3)2 溶液,出现白色沉淀,该白色沉淀是。
【结论】整个实验证明猜想正确。
反应时间(s) | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
滴入稀盐酸体积(mL) | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
温度(℃) | 36.9 | 37.5 | 38.0 | 38.5 | 38.8 | 39.2 | 39.0 | 38.8 | 38.6 |
需要补充一定量的氮元素和钾元素。

①KCl ②NH4HCO3 ③Ca3(PO4)2
设碳酸钙质量为 m
CaCO3 | CO2↑+CaO | |
100 | 44 | |
m | 4.6克 |
100/m=44/4.6 克,所以 m=10.5 克
CaCO3%=10.5 克/10 克×100%=105%
小科的计算结果与事实不符,产生错误的原因是:。
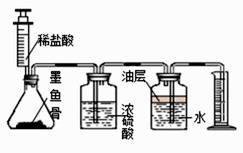
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(毫升) | 10 | 10 | 10 |
进入量筒内水的体积(毫升) | 220 | 220 | 110 |