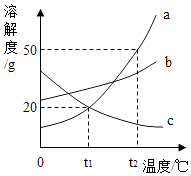
H2C2O4•2H2O 3H2O+CO↑+CO2↑
草酸晶体的其他性质如下:
熔点 | 沸点 | 溶解度(0℃) | 热稳定性 | 与碱反应 |
101℃~102℃ | 150℃~160℃ | 3.54g | 100.1℃失去结晶水,175℃分解成CO2 , CO,H2O | 与Ca(OH)2反应产生白色沉淀(CaC2O4) |
该小组设计的装置如下:图1是加热分解装置,图2是验证分解产物的装置.
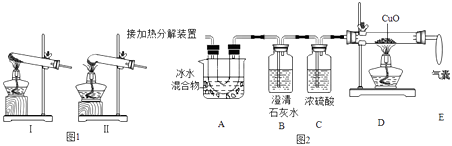
该小组称量纯碱草酸晶体的质量为10.0g,完全反应后A装置增加的质量为ag,B装置增加的质量为bg,D装置减少的质量为dg.实验过程中还能够观察到A中有液体和晶体.