![]()
相关信息列表如下:
物质 | 相对分子质量 | 沸点/℃ | 密度g/mL | 溶解性 |
硝基苯 | 123 | 210.9 | 123 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 93 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
甲苯 | 92 | 110.6 | 0.872 | 略 |
实验步骤为:
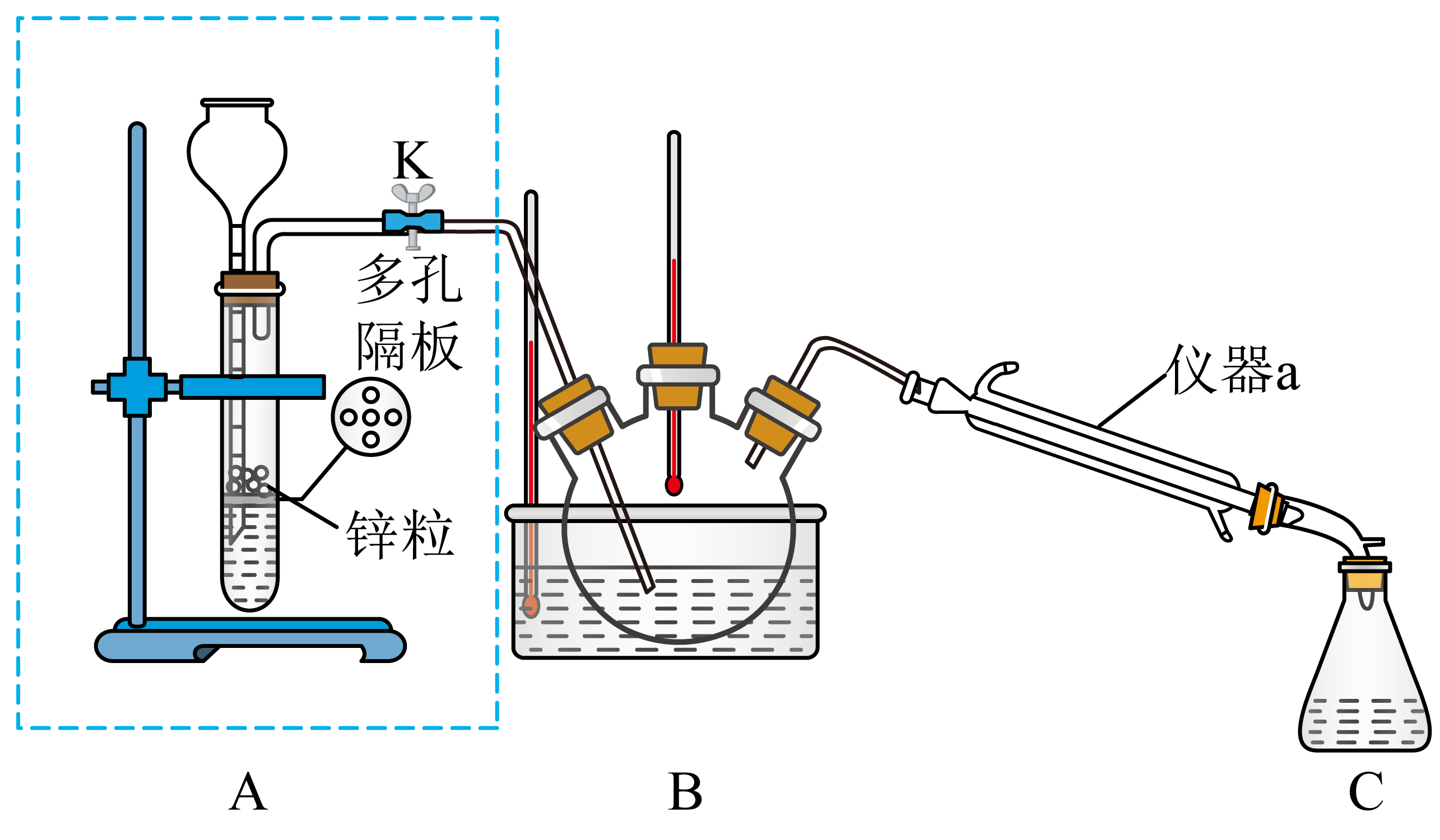
①组装好实验装置(如图,部分夹持仪器已略去),并检查装置气密性。
②向三颈烧瓶中依次加入沸石及10mL硝基苯。
③打开活塞K,先通入H2一段时间。
④使三颈烧瓶内溶液保持140℃恒温,充分反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入干燥剂。
⑥继续加热,收集182~186℃馏分,将所得馏分进行二次纯化,最终得到较纯苯胺5.6g。
回答下列问题:
a.稀盐酸 b.稀硝酸 c.稀硫酸
a.浓硫酸 b.碱石灰 c.无水硫酸镁 d.五氧化二磷
蒸馏所得苯胺中混有少量硝基苯杂质,可以采用如下方案除杂提纯:

加入试剂X后发生反应的离子方程式为,“液相”是(填“水层”或“有机层”)。
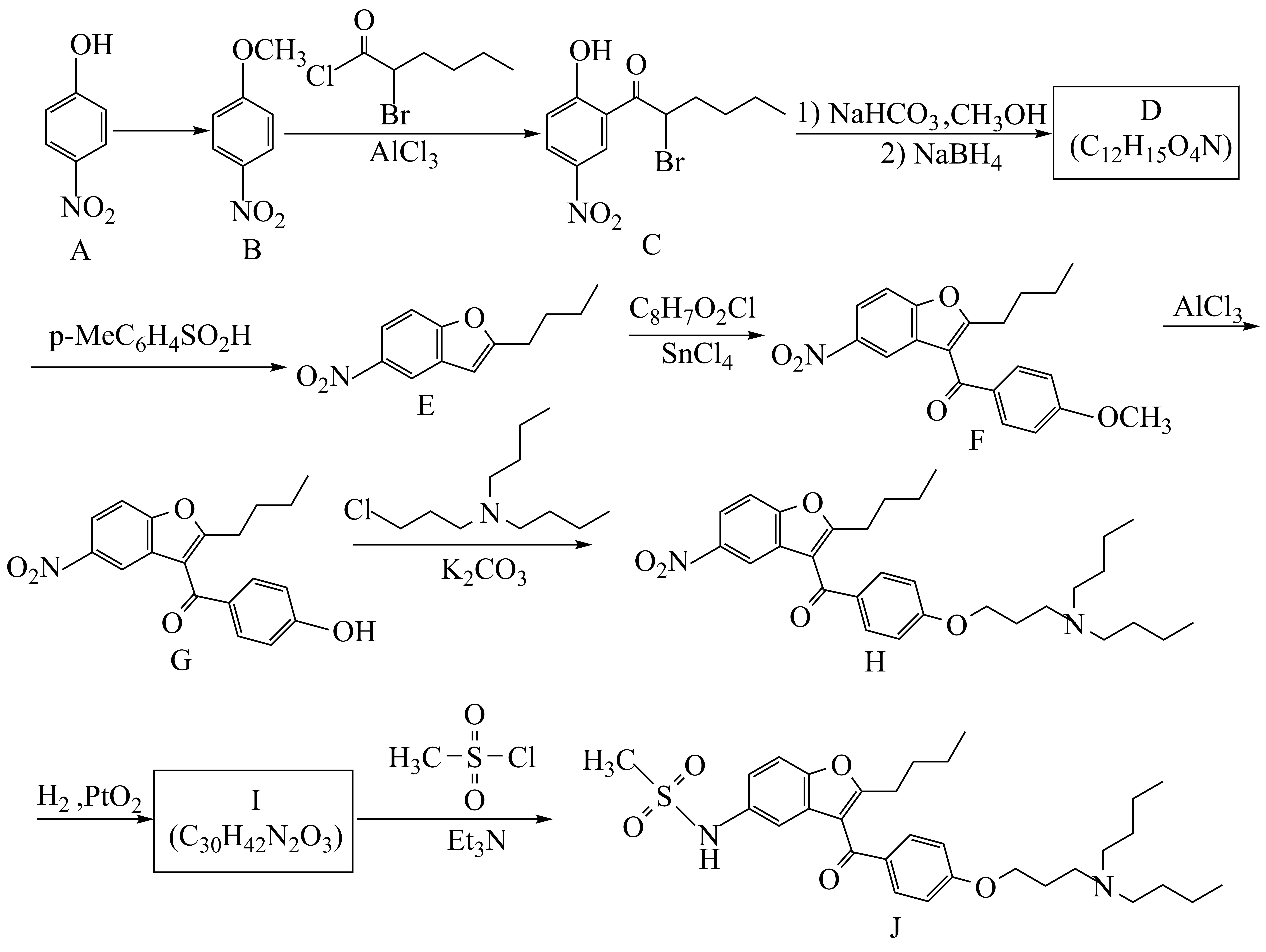
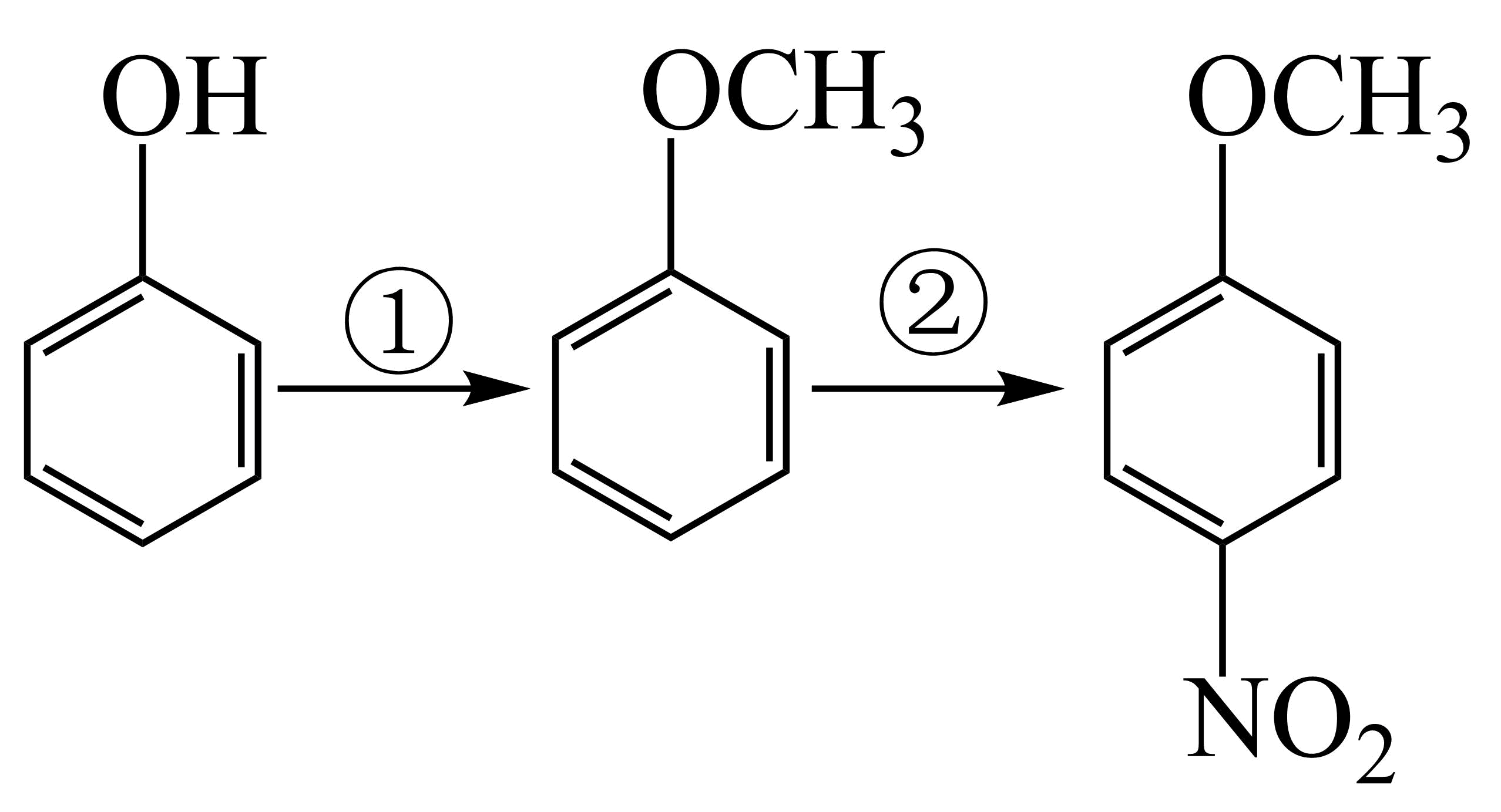
已知:![]()
回答下列问题:
①含有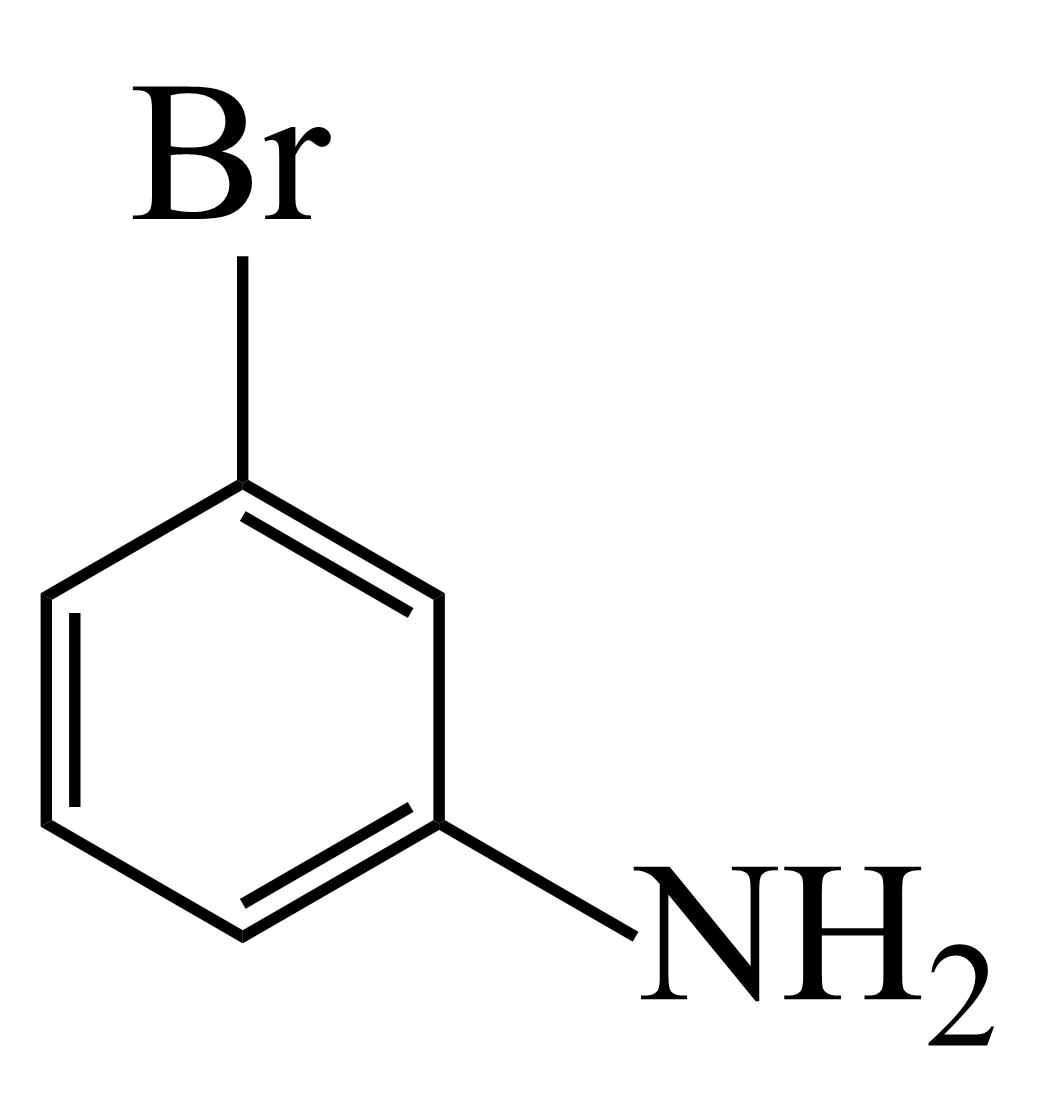 结构;
结构;
②苯环上只有3个取代基且相邻;
③1molM与足量NaHCO3溶液反应产生2molCO2气体。
其中,核磁共振氢谱显示7组峰,且峰面积比为4:2:2:1:1:1:1的同分异构体结构简式为。
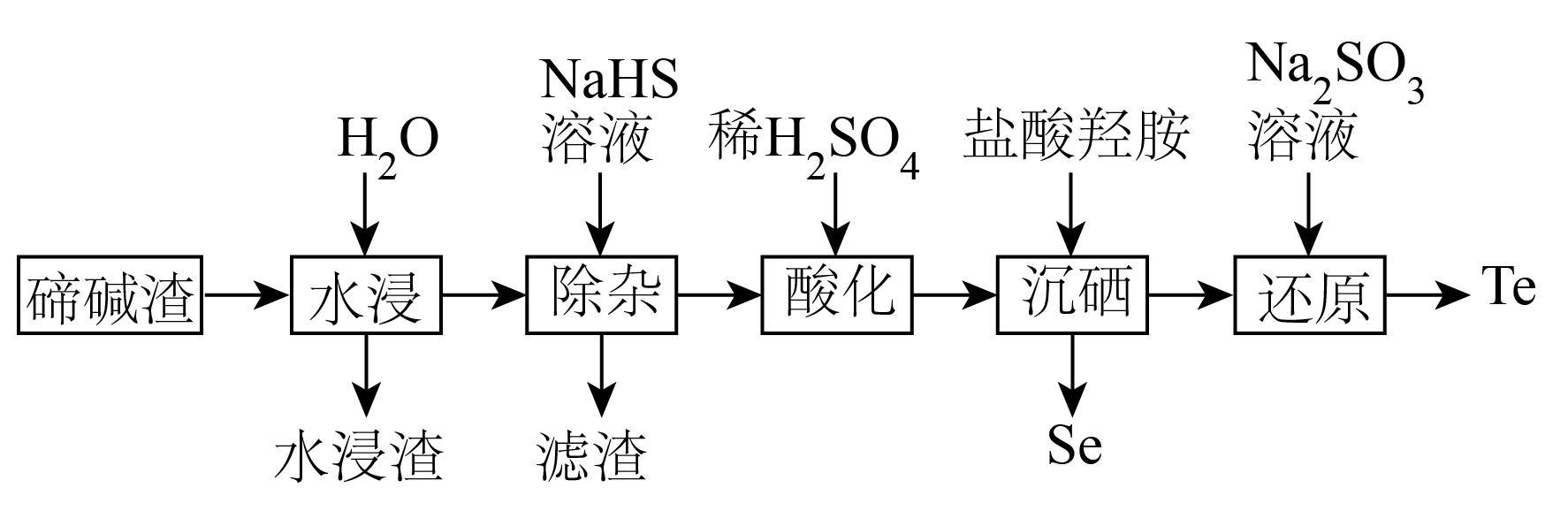
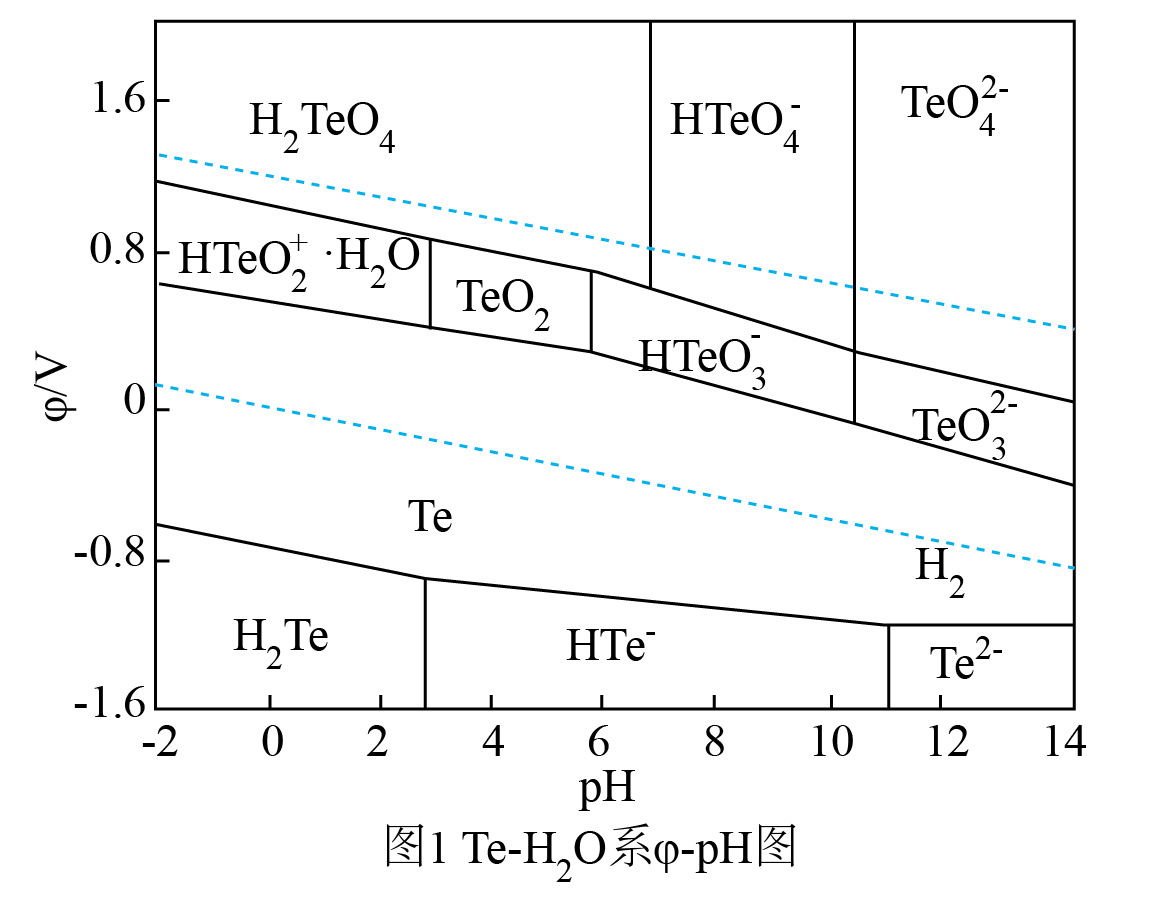
已知:①时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
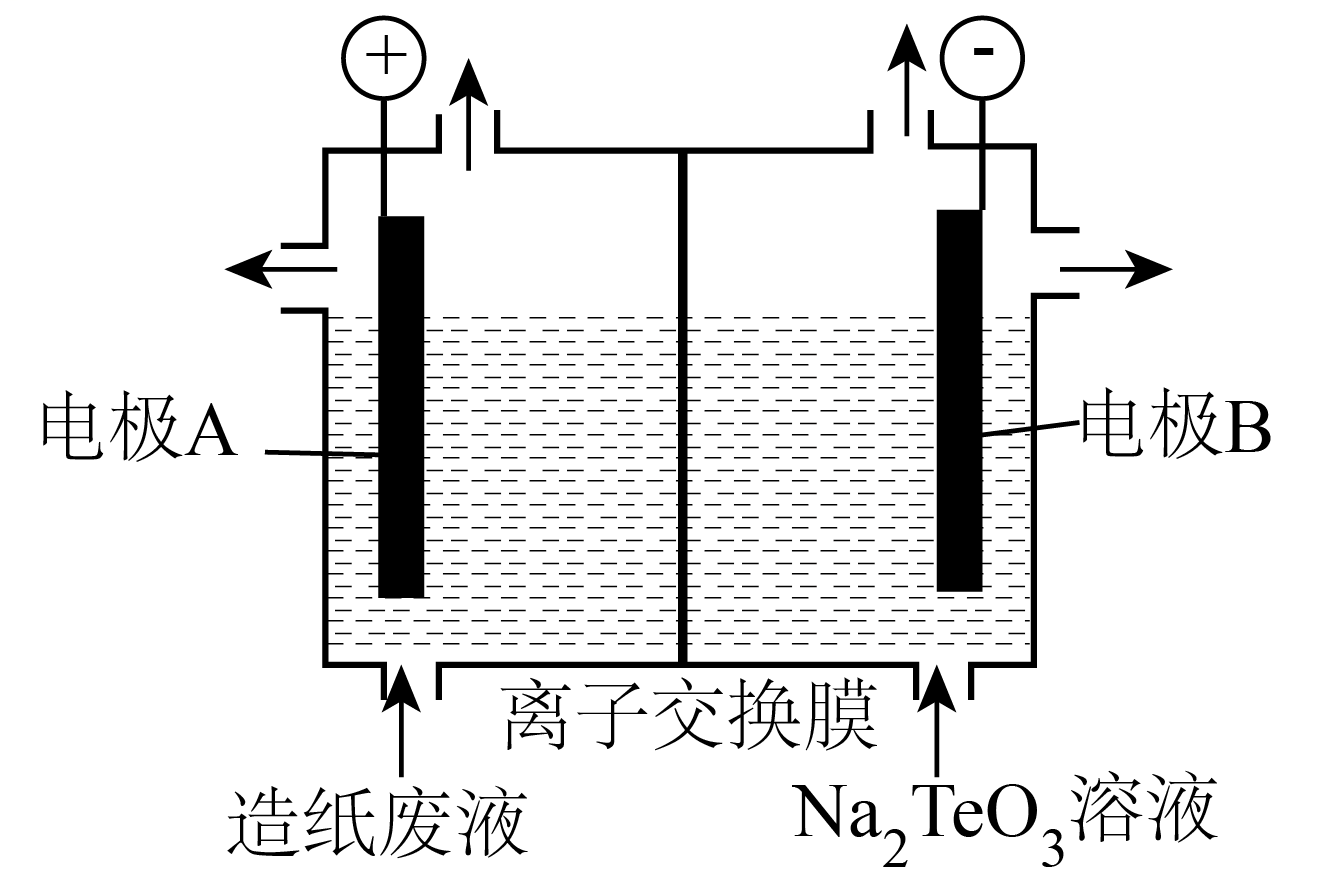
选项 | 实验 | 现象 | 结论 |
A | 向两份等体积等浓度的新制氯水中,分别滴加AgNO3溶液和淀粉KI溶液 | 前者产生白色沉淀,后者溶液变为蓝色 | 氯气与水的反应存在限度 |
B | 将苯与液溴在催化剂作用下产生的气体通入硝酸银溶液中 | 产生淡黄色沉淀 | 苯和液溴发生取代反应 |
C | 向1mL0.01mol·L-1MgCl2溶液中滴入2滴0.01mol·L-1NaOH溶液,产生白色沉淀,再滴入2滴0.01mol·L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 向溶有SO2的CaCl2溶液中通入气体X | 产生白色沉淀 | X一定具有强氧化性 |