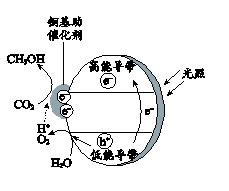
反应i.CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H1
反应ii.CO2(g) + H2(g) CO(g) + H2O(g) △H2= + 41.2 kJ·mol-1
回答下列问题。

① 0~10 min内,平均反应速率v (CH3OH) =mol·L-1·min-1。
② T℃时,反应ii的化学平衡常数K =。
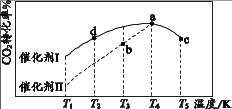
①图中达到化学平衡状态的是(填“a”“b”“c” “d”)。
② 其他条件相同,若将原料气按n (CO2):n(H2)=1:2.8充入同一恒容、密闭容器中,在催化剂I的作用下发生反应。该条件下,a点时CO2的转化率(填“增大”或“不变”或“减小”)。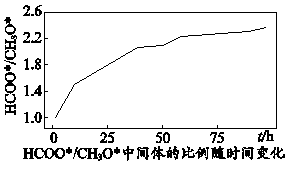
与
物质的量之比随时间变化图如下:
第一步
第二步
第三步
下列说法正确的是。
A.其他条件相同时,升高温度时,三步反应速率均加快
B.用不同催化剂催化反应可以改变反应历程,提高平衡转化率
C.反应历程中,第二步反应的活化能最高,是反应的决速步骤