①![]() 和
和![]() 中所有原子均共面,其中氮原子较易形成配位键的是。
中所有原子均共面,其中氮原子较易形成配位键的是。
②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容易提供孤电子对。则对于配合物Fe(SCN)3 , 配体SCN-中提供孤电子对的原子是(填元素符号)。
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是。
A.[Cu(NH3)2]Cl B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.[Cr(H2O)5Cl]Cl2
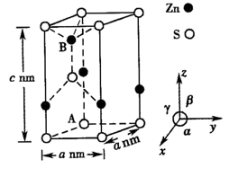
①该晶体中,锌的配位数为。
②已知空间利用率 , 设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为。
微信扫码预览、分享更方便