1.
(2021·吕梁模拟)
以软锰矿粉(主要含有MnO2 , 还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
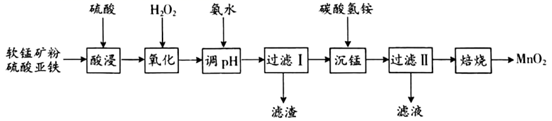
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38 , Ksp[Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子的物质的量浓度小于或等于1×10-5 mol·L-1时,可视为该金属离子已被沉淀完全。
-
(1)
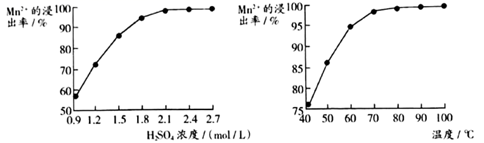
“酸浸”实验中,锰的浸出率结果如下图所示。由图可知,软锰矿粉酸浸的适宜条件是
。
-
-
(2)
酸浸后,锰主要以Mn2+的形式存在,写出相应的离子方程式。
-
-
(3)
若氧化后c(Al3+)=0.02 mol/L,加入氨水(设溶液体积增加1倍),使Fe3+完全沉淀,此时是否有Al(OH)3沉淀生成?(列式计算);想要达到实验目的,加入氨水应调节pH的范围为。
-
-
(4)
加入碳酸氢铵产生沉淀的过程称为“沉锰”,“过滤II”所得滤渣为MnCO
3。
①“沉锰”过程中放出CO2 , 反应的离子方程式为。
②“沉锰”过程中沉锰速率与温度的关系如图所示。

当温度高于60℃时,沉锰速率随着温度升高而减慢的原因是。
-
-
-


