A.H2O B.SO3 C.O3 D.CH4

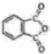 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(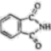 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
已知几种氯化物在常压时的熔、沸点:
| 物质 | SiCl4 | AlCl3 | NaCl | KCl | CaCl2 |
| 沸点/℃ | 58 | 180 | 1465 | — | 1935 |
| 熔点/℃ | -69 | — | 801 | 771 | 775 |
回答下列问题:
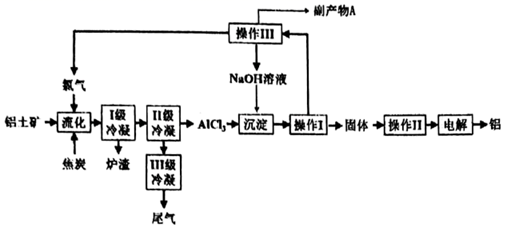
①“流化过程中NaAlSi3O8发生的化学反应方程式为.
②Ⅱ级冷凝的温度不能高于℃

①氮和氧中第一电离能较大的元素是,原因是
②H2O和NH3中键角较大的分子是,[Cr(NH3)4(H2O)2]3+的同分异构体共有种,其结构中铬离子的外围电子数目为。
③1molCr(CH3COO)3所含σ键的数目为。

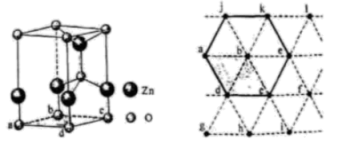
①晶体a中铬原子的配位数为。
②晶体b中铬原子填充在由铜原子构成的(填“四面体”“六面体”或“八面体”)空隙中,NA表示阿伏加德罗常数的值,则晶体b的密度为。