
[实验步骤]
有同学认为步骤(5)可以设计为:取25.00 mL所配溶液,加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称得BaSO3沉淀的质量。你认为此方案(填“是”或“否”)合理,理由是。
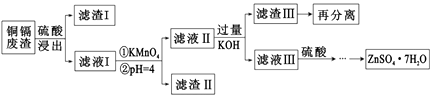
[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO33-。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:

图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
相关主要反应如下:
I. C(s) + H2O(g) CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g) CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g) CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s) CaCO3(s) + 2H2 (g)的△H =kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s) CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是。(填字母编号)
A. 适当的降低体系的温度
B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气
D. 增加CaO的量