选项 | 灭火措施 | 灭火原理 |
A | 用干粉灭火器扑灭燃着的家具 | 降低可燃物着火点 |
B | 将蜡烛吹灭 | 隔绝空气 |
C | 用锅盖盖灭着火的油锅 | 降低温度至着火点以下 |
D | 将树木砍掉形成隔离带,扑灭森林火灾 | 移除可燃物 |
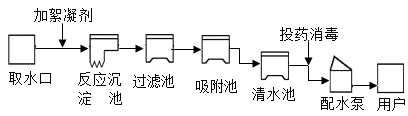
①原料锡砂中的SnO2和木炭反应得到锡和二氧化碳,化学方程式为。
②炼锡时混入少许铅形成合金,产物更易熔化流出,原因是。
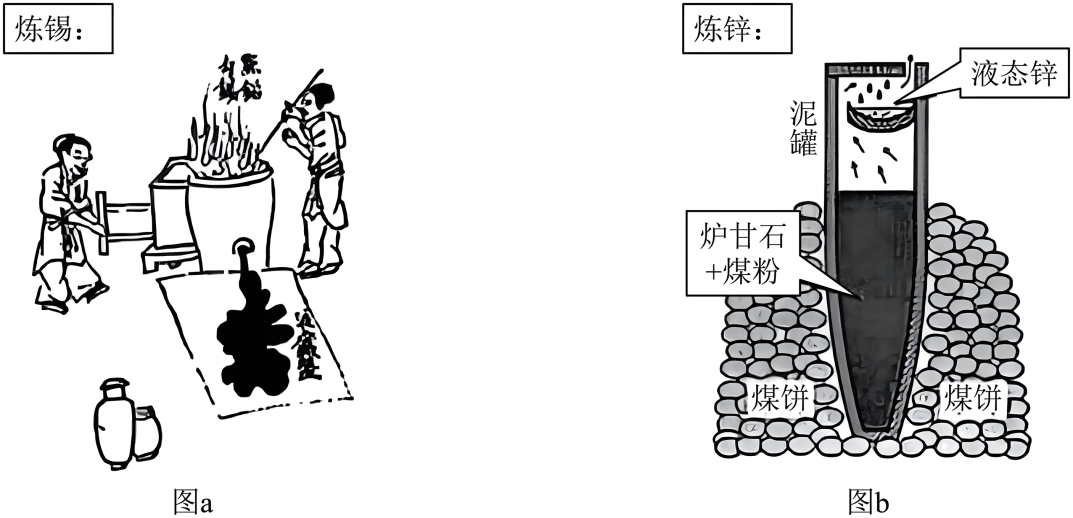
①泥罐外煤饼的主要作用是燃烧提供热量,泥罐内煤粉的主要作用是。
②已知锌的沸点为907℃,泥罐下部温度可达1200℃,上部约为600℃,该工艺从反应混合物中收集液态锌的方法属于(填标号)。
A.结晶 B.蒸发 C.蒸馏 D.升华
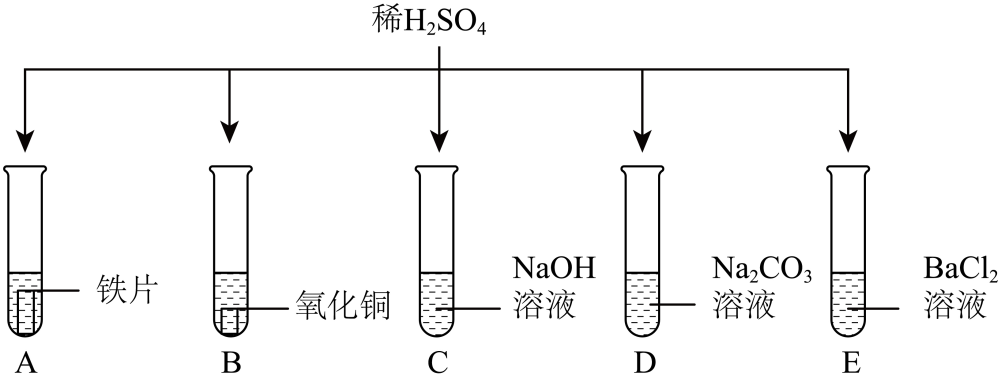
①倒入前试管A中的溶液为黄色②倒入前试管B中稀硫酸有剩余③滤渣中一定有铁和铜④滤液中一定有FeSO4、CuSO4和H2SO4
自然界是一个碳的世界。碳在自然界中的循环变化,对于生态环境有极为重要的意义。随着工业生产的高速发展和人们生活水平的提高,每年排放的二氧化碳越来越多,近一半存留在大气层,其它被陆地和海洋吸收。减少CO2排放,实现碳中和,已成为全球共识,碳替代、碳减排、碳封存、碳循环是实现碳中和的4种主要途径。科学家预测,到2050年4种途径对全球碳中和的贡献率如图1.
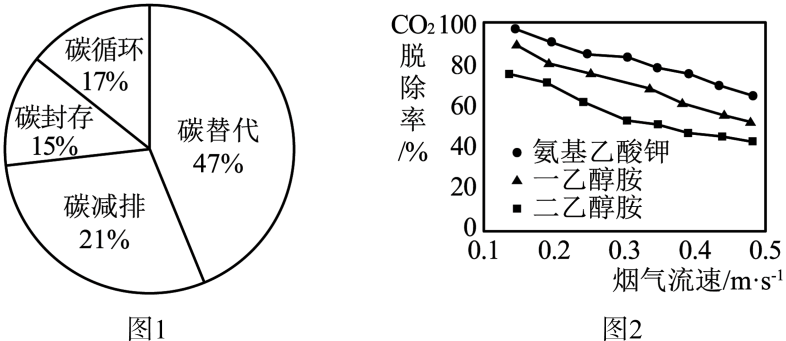
CO2的吸收是碳封存的首要环节,常选用NaOH、氨水、一乙醇胺等作吸收剂。在研究膜吸收法吸收CO2时,研究人员通过实验比较了一乙醇胺、二乙醇胺、氨基乙酸钾3种吸收剂对烟气中CO2的脱除效果,其结果如图2.
我国提出2060年前实现碳中和,彰显了负责任大国的作为与担当。实现碳中和人人有责,让我们从衣食住行点滴做起,节约能源,低碳生活。
依据文章内容回答下列问题:
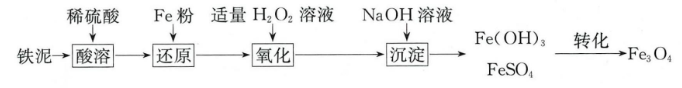
查阅资料:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:

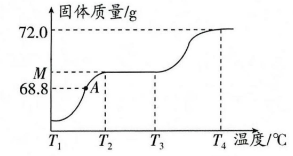
实验操作 | 现象 | 结论 |
取样品加水溶解,加入过量稀盐酸至反应完全 | 有产生 | 样品中有NaCl |
向上述溶液中继续滴加适量AgNO3溶液 | 有产生 |
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
【方案1】将样品溶解,加入过量CaCl2溶液,搅拌至反应完全。该反应的化学方程式为。过滤、洗涤、干燥,称量沉淀的质量,计算Na2CO3的质量分数。

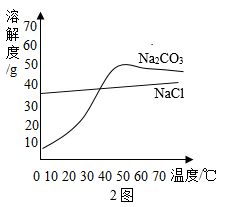
a.40-10 b.60-30 c.70-40