实验Ⅰ:如图甲,将三个盛有等量澄清石灰水的敞口容器编号,并等距离定在铁丝上,在铁丝两侧点燃高、低两支蜡烛,立即用玻璃罩扣上,使铁丝处于正中位置。三个容器内石灰水变浑浊所需的时间如表格所示。
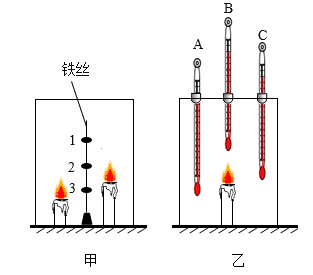
| 容器编号 | 1 | 2 | 3 |
| 时间/秒 | 3.2 | 5.0 | 11.1 |
实验Ⅱ:如图乙,将三支温度计的玻璃泡分别置于玻璃罩内的不同位置。点燃蜡烛,一段时间后,观察到B的示数明显增大,A、C示数增大不明显。
A排队乘电梯依次撤离
B向着火楼层的上方撤离
C用湿毛巾捂住口鼻,弯腰跑离火场
D若火势不大,可用灭火器材将火扑灭
步骤Ⅰ:取一定质量的固体平铺于试管中,通入足量水蒸气。一段时间后,将固体充分干燥并称量,质量不变。
步骤Ⅱ:另取等量固体于试管中,加水振荡,静置后观察到有白色沉淀。向试管中滴加酚酞试剂,上层清液变红。再加入稀盐酸,溶液由红色变为无色,有气泡产生,沉淀消失。
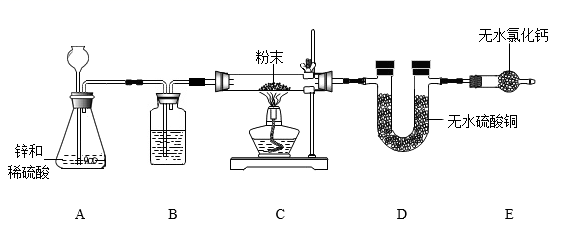
资料:1无水氯化钙常用作干燥剂。
2无水硫酸铜为白色粉末,吸水后变成蓝色固体。
3氢气和全属氧化物加热反应生成金属单质和水。