 稀释浓硫酸
B .
稀释浓硫酸
B .  向试管中加入锌粒
C .
向试管中加入锌粒
C . 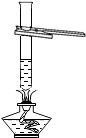 加热液体
D .
加热液体
D .  向试管内倾倒液体
向试管内倾倒液体


①图中所标示的各部件中,属于合成材料的是(填序号).
②自行车的闸线为钢丝,说明金属具有性.
③小明带了一些新鲜水果,主要是为了补充(填营养素名称).
④旅游途中,贝贝发现路边农田里的作物出现了倒伏现象,大家建议应施肥.
⑤旅游回来后,小明给车子零件涂油防止生锈,铁生锈原理,铁与共同作用的结果
①最常用的溶剂; ②可用作补钙剂的盐;
③可用于改良酸性土壤的碱;④可用作调味品的酸.
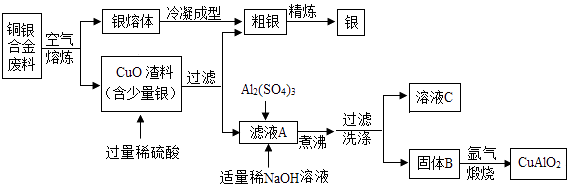
【资料】Ⅰ.难溶性碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化.银在空气中不易被氧化.
请回答下列问题:
【方案设计】小丽、小林两位同学设计了如下方案进行探究:
设计者 | 方案步骤 | 预估现象 | 预估结论 |
小丽 | 用一根洁净的玻璃棒,把试纸呈现的颜色与标准比色卡对照 | pH=7 | 恰好完全中和 |
小林 | 取少量反应后的溶液于一支试管中,并向试管中滴加稀硝酸和硝酸银溶液 | 有白色沉淀生产 | 盐酸过量,没有完全中和 |
【作出猜想】小亮猜想:溶质有NaCl、HCl、NaOH小丽猜想:溶质只有NaCl
小林猜想:溶质有NaCl、HCl 你的猜想:溶质有(填化学式)
小丽认为小亮的猜想是错误的,她的理由是.
实验操作 | 实验现象 | 实验结论 |
取反应后的溶液于试管中,加入碳酸钠溶液 | 小林猜想正确 | |
有蓝色沉淀生成 | 你的猜想正确 |
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3 .
【实验探究】限选试剂及仪器,盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中, | 有气体产生, 气体使石灰水变浑浊. | 猜想2成立 |
②在上述反应后试管中加少量 |
现有实验后的HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图实验方案:

【实验数据】上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应后,共记录了两组实验数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
①m=.
②上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为多少?(不考虑过滤中的损失,计算结果保留到小数点后一位.)